Après avoir décrit les différents tests de diagnostic permettant d’explorer la résistance bactérienne, nous allons décrire dans ce numéro et dans le suivant les différentes classes d’antibiotiques, en commençant par les bêtalactamines [1,2]. Nous présenterons les grandes indications des différents antibiotiques et l’incidence de la résistance à ces molécules chez les principales bactéries d’intérêt médical. Ce bilan permettra notamment de nous rendre compte que, malgré un arsenal thérapeutique très fourni, nous n’avons jamais été aussi près de l’impasse thérapeutique et d’un retour à l’ère pré-antibiotique si un changement radical de l’utilisation de ces médicaments n’était pas impulsé très rapidement en médecine humaine et vétérinaire à l’échelle nationale et internationale [3].
Introduction
La découverte des antibiotiques et leur large utilisation dans les années 1950 ont fait espérer aux scientifiques, médecins et bactériologistes de l’époque la fin des infections bactériennes. En effet, des infections aussi graves que les bactériémies et les fasciites à streptocoque du groupe A ont vu leur pronostic bouleversé par la commercialisation de la pénicilline. Hélas, hormis ces streptocoques bêta-hémolytiques des groupes A et B qui sont étonnamment restés sensibles à la pénicilline, la quasi-totalité des espèces bactériennes a développé des résistances à cet antibiotique et à ses premiers dérivés, lançant le départ d’une course effrénée vers des produits plus performants. Il est intéressant de remarquer qu’au cours des quatre-vingts dernières années un nombre très important de molécules ont été commercialisées avec des objectifs qui se sont modifiés au cours du temps. Initialement, les chimistes et les bactériologistes ont cherché à élargir le spectre d’activité des antibiotiques, c’est-à-dire la liste des espèces et genres bactériens sensibles à une même molécule. Depuis quelques années, une nouvelle attention se porte sur des molécules ayant un spectre plus étroit, ciblant un nombre limité d’espèces bactériennes donc respectant mieux les microbiotes naturels humains.
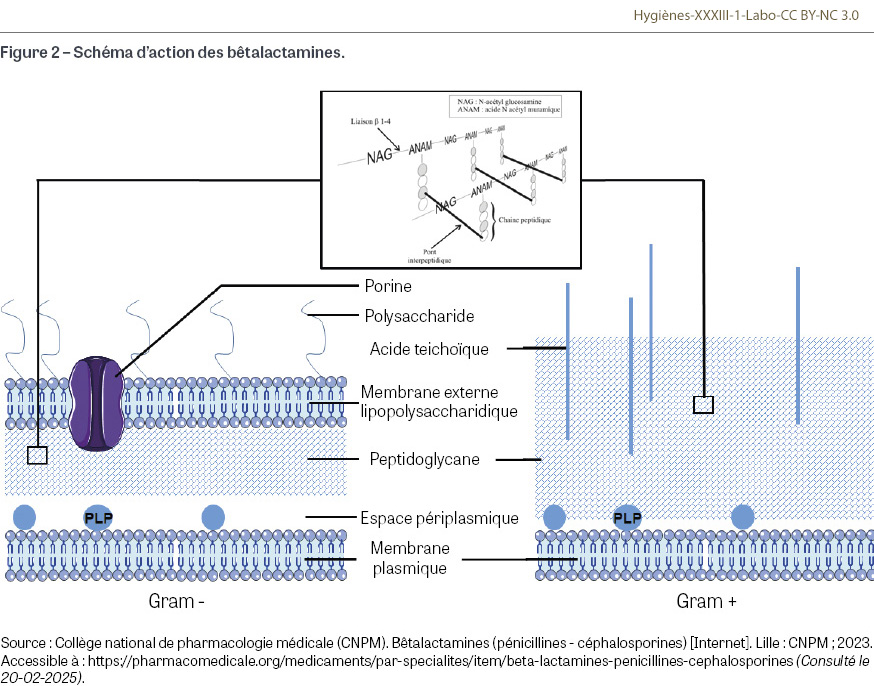
Les bêtalactamines constituent la première classe d’antibiotiques et sont utilisées à la fois en ville et à l’hôpital. Leur spectre d’activité antibactérien, leur très bonne tolérance et leurs paramètres pharmacocinétiques et pharmacodynamiques favorables en font les piliers des traitements empiriques administrés avant de disposer de résultats microbiologiques. Cette facilité d’utilisation a conduit à une très large pression antibiotique sur les communautés bactériennes humaines (microbiotes) mais aussi environnementales. L’origine naturelle de cette classe d’antibiotiques a favorisé l’émergence au sein de ces communautés des premiers mécanismes de résistance, qui n’attendaient qu’une utilisation large de ces molécules par l’homme, en médecine à la fois humaine et vétérinaire, pour se transmettre aux bactéries d’intérêt médical et diffuser à travers toute la planète, notamment par le déplacement des individus ou des animaux hébergeant des souches résistantes. Nous nous limitons dans cet article à l’étude des molécules commercialisées à ce jour en France. Les bêtalactamines sont constituées d’un noyau bêta-lactame (Figure 1A) à partir duquel l’ajout de fonctions chimiques ou les modifications structurelles permettent d’adapter les spectres antibactériens ou les caractéristiques pharmacocinétiques, comme l’absorption par voie orale. Elles regroupent les pénicillines, les céphalosporines et quelques autres dérivés d’intérêt médical notable. Cette classe d’antibiotiques constitue la principale source de molécules thérapeutiques en pathologie infectieuse humaine. Les stratégies thérapeutiques empiriques des infections graves (pyélonéphrite, infection respiratoire, méningite…) comprennent toutes une molécule de la famille des bêtalactamines. Ces stratégies sont sélectionnées sur des taux prévisibles d’échec thérapeutique (correspondant aux taux de résistance acquise) inférieurs à 10% ou à 20% en fonction de la sévérité des infections. Les bêtalactamines inhibent la formation de la paroi bactérienne ; elles doivent atteindre l’espace périplasmique où a lieu la synthèse en continu du peptidoglycane, principal composant de la paroi des bactéries (Figure 2).
Les pénicillines
La pénicilline G (Figure 1B) découverte en 1928 par Alexander Flemming est toujours utilisée en pathologie humaine sous sa forme injectable. De nombreux streptocoques y restent pleinement sensibles et les infections associées (notamment les endocardites) peuvent être traitées par une forme injectable. Par ailleurs les formulations de pénicillines permettant une diffusion prolongée constituent toujours le traitement de référence de la syphilis pour la plupart des stades de cette maladie bactérienne ré-émergente. Des modifications structurales ont permis l’utilisation de cette molécule par voie orale ; connue sous le nom de pénicilline V, elle a été pendant très longtemps utilisée pour traiter les angines à streptocoque du groupe A. Étonnamment, aujourd’hui encore, la résistance des tréponèmes de la syphilis et des streptocoques bêta-hémolytiques — streptocoques du groupe A (Streptococcus pyogenes) des angines et érysipèles, et streptocoques du groupe B (S. agalactiae) des infections maternofœtales — n’existe pas. En revanche, cette résistance s’est développée progressivement chez d’autres streptocoques comme le pneumocoque, par modification des cibles d’action de la pénicilline sur la paroi des bactéries (les protéines liant la pénicilline [PLP]). Concernant Staphylococcus aureus, l’efficacité de la pénicilline a été éphémère (la résistance s’est diffusée très rapidement via un gène produisant une pénicillinase) et aujourd’hui plus de 90% des souches de S. aureus sont résistantes à la pénicilline. Une nouvelle classe de pénicillines a donc été développée, les pénicillines M, qui ont une activité conservée contre les souches de staphylocoque productrices de pénicillinase qui constituent leur unique indication. La méticilline (Figure 1C) puis l’oxacilline et la cloxacilline ont ainsi été commercialisées ; les deux dernières molécules continuent à être utilisées dans le traitement de première intention des souches de staphylocoque dites « sensibles à la méticilline ». Cependant, des souches de S. aureus résistantes à la méticilline (SARM) sont apparues très rapidement après leur commercialisation par acquisition d’une PLP supplémentaire (la PLP2a). Ces souches de SARM et les autres souches de staphylocoque à coagulase négative (S. epidermidis, S. haemolyticus, S. capitis…) résistantes à la méticilline sont également résistantes à toutes les bêtalactamines hormis certaines céphalosporines dites de cinquième génération (cf. infra). En 2023, 8,8% des souches de S. aureus isolées d’hémocultures en France à l’hôpital étaient résistantes à la méticilline [4]. Ce taux remarquablement bas par rapport à de nombreux pays européens est au moins partiellement lié à une politique volontariste de lutte contre la transmission croisée au sein des hôpitaux français [5,6]. La pénicilline est inefficace sur les bactéries à Gram négatif, principalement pour des raisons de diffusion. De nouvelles pénicillines ont été développées, les pénicillines du groupe A, telle l’ampicilline. Celle-ci, mal absorbée par voie orale a été remplacée par l’amoxicilline qui constitue aujourd’hui la principale molécule antibiotique utilisée en pratique de ville (Figure 1D).
L’amoxicilline
Concernant les bactéries à coloration de Gram positive, l’amoxicilline est toujours efficace contre la très grande majorité des pneumocoques de sensibilité diminuée à la pénicilline lorsqu’elle est donnée à forte dose : en 2022, 97,4% des souches de pneumocoque y restaient sensibles [7]. Parmi les entérocoques, l’espèce principale Enterococcus faecalis est constamment sensible à l’amoxicilline alors que la majorité des souches d’E. faecium isolées à l’hôpital sont devenues résistantes à cause d’une modification de la PLP5 (21,1% de souches d’E. faecium isolées d’hémocultures étaient sensibles à l’amoxicilline en 2022 à l’hôpital) [8]. Toutes les souches de Listeria monocytogenes demeurent à ce jour sensibles à l’amoxicilline qui reste le traitement de choix des méningites et des infections néonatales à ce redoutable bacille à coloration de Gram positive. L’amoxicilline a conservé une efficacité vis-à-vis de certaines entérobactéries comme Escherichia coli, Proteus mirabilis, les shigelles et les salmonelles. La résistance par acquisition d’une bêtalactamase située sur un élément génétique mobile (plasmide, transposon…) s’est rapidement développée chez ces espèces (en 2022, seulement 45,8% des souches d’E. coli isolées à l’hôpital à partir d’hémocultures restaient sensibles à l’amoxicilline [8]). D’autres entérobactéries comme Klebsiella pneumoniae disposent naturellement d’une bêtalactamase chromosomique qui hydrolyse l’amoxicilline et la rend toujours inefficace. Parmi les molécules étudiées jusqu’à présent, aucune n’était active contre Pseudomonas aeruginosa, bacille à coloration de Gram négative particulièrement incriminé parmi les micro-organismes responsables d’infections nosocomiales et notamment lors de pneumopathies acquises sous ventilation en réanimation. Les raisons sont multiples : difficultés de pénétration, présence d’enzymes hydrolytiques et de pompes d’efflux [9]. Des pénicillines spécifiques ont ainsi été développées : ce sont les carbénicillines (ticarcilline) et les uréidopénicillines (pipéracilline) (Figure 1E). Cette dernière molécule constitue à ce jour le traitement de première intention des infections à P. aeruginosa ne présentant pas de résistance acquise — en 2022, ces souches représentaient 80% de celles isolées d’hémoculture à l’hôpital [8]. Les carbénicillines et les uréidopénicillines sont également efficaces contre certaines entérobactéries naturellement résistantes à l’amoxicilline : K. aerogenes, Enterobacter cloacae complex, Citrobacter freundii…
Les céphalosporines
À côté des pénicillines, une autre classe de bêtalactamines a fait l’objet de nombreux développements, les céphalosporines, dont de nombreuses molécules font partie de l’arsenal de base contre de très nombreuses bactéries. Les céphalosporines ont été élaborées autour d’un noyau particulier, le noyau céphème (Figure 1F), qui leur donne plusieurs particularités dont la résistance aux pénicillinases et une activité restaurée sur certaines entérobactéries. Elles sont classées en cinq générations successives.
Les céphalosporines de 1re génération – céfazoline
Les céphalosporines de 1re génération (C1G) sont efficaces et très utilisées contre les souches de staphylocoque productrices de pénicillinase au même titre que les pénicillines M. Comme ces dernières, les C1G sont mal absorbées par voie orale et leur utilisation pour traiter les infections à S. aureus par cette voie a progressivement diminué. Les C1G sont efficaces sur la majorité des souches sans résistance acquise aux bêtalactamines d’E. coli et de K. pneumoniae. Ce spectre d’activité justifie une utilisation très large en antibioprophylaxie lorsque ces espèces sont ciblées. Les C1G sont inefficaces contre tous les entérocoques, Listeria monocytogenes, les espèces d’entérobactéries sécrétant naturellement une céphalosporinase (K. aerogenes, Enterobacter cloacae complex, Citrobacter freundii, Morganella morganii…) et P. aeruginosa. Elles ont également une mauvaise affinité pour les PLP modifiées des souches de pneumocoque de sensibilité à la pénicilline — elles ne doivent pas être utilisées pour le traitement empirique des infections respiratoires ou oto-rhino-laryngologiques lorsque cette espèce est potentiellement impliquée. Les modifications chimiques appliquées aux C1G ont permis une augmentation de leur activité vis-à-vis des entérobactéries, du pneumocoque et de P. aeruginosa au détriment de leur activité sur les staphylocoques.
Les céphalosporines de 2e génération – céfuroxime, céfamandole, céfoxitine
Les céphalosporines de 2e génération (C2G) présentent quelques particularités intéressantes, en plus d’une activité légèrement augmentée sur les entérobactéries. Le céfamandole garde une bonne activité sur les staphylocoques sensibles à la méticilline. Il est utilisé en traitement curatif sur les infections à S. aureus mais également en antibioprophylaxie pour les chirurgies propres. Le céfuroxime a été largement utilisé en ville sous une forme orale (céfuroxime axétil) ; mais son manque d’activité sur les pneumocoques de sensibilité diminuée à la pénicilline le fait désormais réserver à l’antibioprophylaxie par voie injectable. La céfoxitine est une C2G particulière appartenant à la classe des oxyimino-céphalosporines. Elle est la seule céphalosporine (avec le céfotétan) ayant une activité sur les bactéries anaérobies, ce qui en fait une candidate de choix pour l’antibioprophylaxie lors des chirurgies des voies digestives. Par ailleurs elle garde une activité en cas de présence d’une bêtalactamase à spectre élargie (BLSE) ; elle peut donc être utilisée à la fois en prophylaxie et sous certaines conditions d’administration en traitement curatif sur les entérobactéries productrices de BLSE.
Les céphalosporines de 3e génération – céfotaxime, ceftriaxone, ceftazidime
Les céphalosporines de 3e génération (C3G) sont des molécules essentielles en antibiothérapie curative des infections graves. Elles sont ainsi très fréquemment utilisées dans les protocoles d’antibiothérapie empirique. Les résistances acquises aux C3G posent des problèmes thérapeutiques importants qui obligent à élargir le spectre antibactérien de ces antibiothérapies empiriques, par exemple en ajoutant une autre molécule (un aminoside) en cas d’infection grave. Le céfotaxime (Figure 1G) et la ceftriaxone possèdent le même spectre d’activité (pneumocoques, streptocoques et entérobactéries). Ils ne sont pas efficaces sur les staphylocoques, les entérocoques, les bactéries anaérobies, L. monocytogenes et P. aeruginosa. La ceftriaxone possède une demi-vie d’élimination plus longue, permettant une seule injection quotidienne, de surcroît possiblement par voie sous-cutanée ce qui en fait une molécule de choix en gériatrie. À l’inverse, son passage hépato-biliaire fait craindre des conséquences délétères plus importantes sur le microbiote intestinal. En 2023, 90,7% des souches d’E. coli isolées chez des patients vivant en établissement d’hébergement pour personnes âgées (Ehpad) et 96,2% des souches des patients vivant à domicile étaient sensibles à ces C3G [4,10]. La quasi-totalité des pneumocoques est sensible (99,8%) au céfotaxime lorsqu’il est administré à forte dose [7]. À l’hôpital en 2022, 90% des souches d’E. coli isolées d’hémocultures étaient sensibles aux C3G [6]. Ces taux n’étaient plus que d’environ 75% et 50% pour respectivement K. pneumoniae et Enterobacter cloacae complex [8]. Le céfotaxime est donc une molécule majeure pour traiter de façon empirique les infections sévères à entérobactérie ou à pneumocoque. Le ceftazidime (Figure 1H) est la céphalosporine de référence contre P. aeruginosa (en 2022, 85,5% des souches isolées d’hémocultures à l’hôpital étaient sensibles à cette molécule [8]).
Les céphalosporines de 4e génération – céfépime
Céphalosporine de 4e génération, le céfépime présente plusieurs particularités intéressantes : il garde une certaine activité contre S. aureus sensible à la méticilline, il est efficace sur P. aeruginosa à un niveau équivalent à celui du ceftazidime, et il conserve une activité sur les entérobactéries produisant une grande quantité de céphalosporinases dont le gène est naturellement présent ou a été secondairement acquis. Cette molécule est donc très utilisée pour le traitement empirique d’une infection nosocomiale chez des patients à risque de faire une forme grave (neutropénie fébrile, pneumopathie acquise sous ventilation…).
Les céphalosporines de 5e génération – ceftobiprole, ceftaroline
Les modifications et la synthèse chimique ont permis ce que l’on pensait impossible : obtenir des bêtalactamines gardant une efficacité contre les SARM, souches bactériennes considérées précédemment comme résistantes à toutes les bêtalactamines. Le ceftobiprole possède également une activité sur les bacilles à coloration de Gram négative responsables d’infections associées aux soins. Malgré cela, ces molécules peinent à trouver leur place au sein des stratégies thérapeutiques en France.
Les autres dérivés des bêtalactamines
Les carbapénèmes – imipénème, méropénème, ertapénème
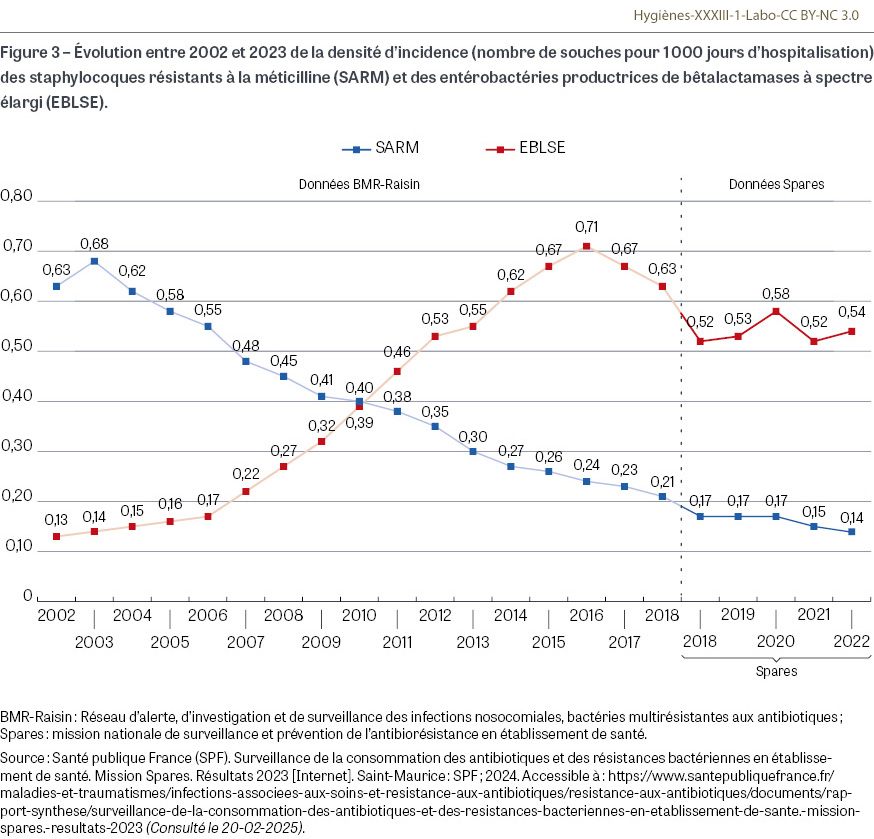
Depuis leur découverte en 1985, les entérobactéries résistantes aux C3G par production d’une BLSE constituent un problème croissant de santé publique. Si cette résistance était initialement limitée aux entérobactéries responsables d’infections nosocomiales (K. pneumoniae, E. cloacae, K. aerogenes…), les années 2000 ont vu apparaître et diffuser à une vitesse vertigineuse une nouvelle classe de BLSE produite à partir des gènes blaCTX-M1 principalement chez E. coli, en parallèle d’une diminution de l’incidence des infections à SARM évoquée précédemment (Figure 3). Ces souches ont diffusé à la fois à l’hôpital et, ce qui est nouveau, en ville. E. coli étant la première espèce bactérienne responsable d’infections communautaires ou nosocomiales, les conséquences de cette émergence ont été majeures, avec un risque d’inefficacité des traitements empiriques largement basés, comme nous l’avons mentionné, sur des C3G chez des patients ne présentant pas les facteurs de risque habituels de portage de ce type de bactéries multirésistantes (pyélonéphrites chez la femme jeune, infections digestives communautaires voire infections néonatales). En 2023, les souches productrices de BLSE représentaient chez E. coli 7,4% des souches isolées d’hémocultures à l’hôpital, jusqu’à 5,8% des souches de patients vivant à domicile dans l’hexagone et 21% de celles de patients vivant en Ehpad [4,10]. Pour K. pneumoniae, ces mêmes chiffres étaient respectivement de 20,9%, 10,0% et 26,4% [6,8]. De nouvelles bêtalactamines résistantes à la fois à l’hydrolyse par les pénicillinases, les BLSE et les céphalosporinases hyperproduites ont été conçues à partir d’un noyau bêta-lactame modifié. Ce sont les carbapénèmes, qui possèdent également une excellente activité sur les bactéries anaérobies et sur P. aeruginosa (sauf pour l’ertapénème) (Figure 1I). L’imipénème a été la première molécule développée. Instable en solution, elle ne permet pas d’utiliser des perfusions continues pour l’administrer, approche pourtant souvent utilisée lors des infections graves afin d’améliorer l’efficacité des bêtalactamines ; de plus ses propriétés convulsivantes ne permettent pas d’augmenter les doses dans le but de favoriser un passage méningé (en 2022 à l’hôpital, plus de 99% des souches d’E. coli et de K. pneumoniae isolées d’hémocultures étaient sensibles à l’imipénème [8]). Le méropénème a corrigé ces défauts et est désormais considéré comme le carbapénème de référence (en 2022 à l’hôpital plus de 90% des souches de P. aeruginosa étaient sensibles au méropénème [8]). L’ertapénème peut être administré en une seule injection, éventuellement par voie sous-cutanée. Il est par contre inefficace sur P. aeruginosa. Cette molécule peut constituer une solution intéressante pour le traitement d’un patient en ville (prostatite à E. coli BLSE par exemple). En revanche, son utilisation en antibioprophylaxie en cas d’intervention chirurgicale colique chez un patient porteur d’une BLSE est très discutée afin de préserver l’efficacité curative de cette classe d’antibiotiques. Comme attendu, des mécanismes de résistance aux carbapénèmes sont apparus : diminution de la pénétration de l’antibiotique à l’intérieur de l’espace périplasmique ou augmentation de son efflux vers l’extérieur chez P. aeruginosa principalement, émergence et diffusion de nouvelles bêtalactamases ayant une activité de carbapénémase (chez les entérobactéries, P. aeruginosa et Acinetobacter baumannii) [9]. Ces souches représentent 10% des isolats de P. aeruginosa ; elles restent très rares chez les entérobactéries (moins de 1% chez E. coli mais déjà 2,1% des souches de K. pneumoniae isolées d’hémocultures à l’hôpital en 2023) [4]. En parallèle, il est intéressant de noter que les patients allergiques aux pénicillines ou aux céphalosporines peuvent pour la plupart recevoir un carbapénème sans risque de réaction croisée.
Les monobactames – aztréonam
Comme leur nom l’indique, les monobactames ne possèdent qu’un cycle au niveau du noyau bêta-lactame (Figure 1J). Cela leur confère des propriétés intéressantes. L’aztréonam, seul représentant des monobactames, peut être administré aux patients allergiques aux pénicillines ou aux céphalosporines. Cette molécule n’a aucune activité sur les bactéries à coloration de Gram positive ni sur les bactéries anaérobies. Initialement considéré comme un défaut, ce spectre étroit est désormais un argument lorsque l’on veut épargner les microbiotes des patients. Son spectre d’activité inclut les entérobactéries et P. aeruginosa. Sensible aux enzymes de type céphalosporinase hyperproduite ou BLSE, l’aztréonam n’est étonnamment pas hydrolysé par les carbapénémases qui posent le plus de problèmes thérapeutiques — les métallo-carbapénémases de classe B retrouvées chez certaines souches d’entérobactéries ou de P. aeruginosa (blaVIM ou blaNDM2). Cette molécule peut donc constituer une solution thérapeutique contre ces bactéries multirésistantes émergentes, seule ou en association avec un inhibiteur de bêtalactamases (cf. infra).
Le céfidérocol
Cette molécule est la dernière-née des bêtalactamines [11]. Elle est active sur les bactéries productrices de bêtalactamases, y compris les carbapénémases. Elle pénètre dans la bactérie par la voie des sidérophores, molécules de captation du fer extérieur indispensable à la survie des bactéries. Elle constitue donc la dernière molécule de la famille pour traiter les souches d’entérobactérie, de P. aeruginosa et même de Stenotrophomonas maltophilia multirésistantes. Néanmoins, des résistances acquises ont déjà été décrites, incluant des mutations sur les gènes impliqués dans le transport du fer ou sur certaines carbapénémases.
Les inhibiteurs de bêtalactamases
Nous avons vu qu’un des principaux mécanismes de résistance aux bêtalactamines était la production de bêtalactamases. L’ajout de molécules chimiques inhibant ces enzymes est donc apparu comme une stratégie pertinente pour surmonter la résistance. Ces molécules peuvent être des leurres chimiquement dérivés des bêtalactamines ou des composés très différents. Les bactéries anaérobies produisant souvent des bêtalactamases, l’ajout d’un inhibiteur permet d’élargir le spectre des associations d’antibiotiques obtenues.
L’acide clavulanique
L’acide clavulanique (Figure 1K) est une bêtalactamine dotée d’une faible action antibactérienne mais qui inhibe les pénicillinases en les détournant de la bêtalactamine active qui lui est associée. Il est néanmoins inefficace sur les céphalosporinases, dont il favorise même la production. L’association amoxicilline-acide clavulanique est l’antibiotique le plus consommé en milieu hospitalier. En plus du spectre de l’amoxicilline, il permet de retrouver une activité sur les entérobactéries productrices naturellement ou par acquisition de matériel génétique mobile d’une pénicillinase, y compris les BLSE. Néanmoins il est nécessaire que les deux composés de l’association soient présents en grande quantité au sein du tissu infecté, ce qui ne permet que très rarement de l’utiliser pour traiter des infections à bactérie productrice de BLSE, hormis certaines infections urinaires sans signe de gravité [12]. Il est intéressant de noter que, contrairement à la Haute Autorité de santé (HAS), les infectiologues nord-américains excluent l’utilisation de l’amoxicilline-acide clavulanique pour le traitement des infections à entérobactérie BLSE quelles qu’elles soient [12,13].
Le tazobactam
Le tazobactam inhibe les céphalosporinases et les pénicillinases. Combiné à la pipéracilline, il permet de récupérer une activité sur de très nombreuses souches d’entérobactérie en gardant l’activité de la pipéracilline sur P. aeruginosa. En considérant l’activité intrinsèque de la pipéracilline sur les entérocoques, et l’élargissement du spectre sur les bactéries anaérobies grâce au tazobactam, cette association est un traitement de choix des infections digestives sévères ou nosocomiales. Comme pour le céfépime, elle peut également être utilisée pour prendre en charge les neutropénies fébriles lorsqu’une composante digestive est suspectée. L’association pipéracilline-tazobactam garde souvent une activité théorique contre les entérobactéries productrices de BLSE. Comme pour l’association amoxicilline-acide clavulanique, les recommandations nord-américaines sont beaucoup plus réservées que celles de la HAS quant à une utilisation clinique de l’association pipéracilline-tazobactam pour traiter les infections à entérobactérie productrice de BLSE [12,13]. Associée au ceftolozane, une C3G agissant sur P. aeruginosa, cette combinaison constitue un traitement particulièrement efficace contre les infections dues à ce micro-organisme, hormis en cas de production par la bactérie d’une métallo-carbapénémase dont il faut suspecter l’existence en cas de souche résistante à cette association.
L’avibactam
L’avibactam est un inhibiteur synthétique des bêtalactamases incluant les pénicillinases, les céphalosporinases, les BLSE et même certaines carbapénémases de classe A (blaKPC3) ou de classe D (blaOXA-484). Associée au ceftazidime, la combinaison est une alternative théorique aux carbapénèmes pour traiter des infections à entérobactérie productrice de BLSE. Néanmoins, les recommandations françaises et américaines s’accordent sur le fait de les réserver au traitement des bacilles à coloration de Gram négative producteurs des carbapénémases de classe A et D [12,13]. Associé à l’aztréonam, l’avibactam permet d’obtenir une combinaison efficace à la fois contre les BLSE et les carbapénémases, y compris les métallo-enzymes. C’est également une association prometteuse pour traiter les infections sévères à S. maltophilia [13].
Le relebactam et le vaborbactam sont des inhibiteurs des carbapénémases de classe A (blaKPC), très présentes aux États-Unis. Associés aux carbapénèmes, ils restituent leur activité. L’association imipénème-relebactam permet étonnamment de retrouver une activité chez les souches de P. aeruginosa ayant perdu la porine qui permettait à l’imipénème de pénétrer dans l’espace périplasmique et responsable de la résistance de la souche.
D’autres bêtalactamines
Il est intéressant de noter que certaines anciennes bêtalactamines, abandonnées pendant un temps, ont vu leur intérêt et leur commercialisation reprendre au regard de certaines de leurs particularités. La témocilline, dérivé ancien de la ticarcilline, garde une activité sur les entérobactéries productrices de bêtalactamases à spectre élargi. Elle peut être utilisée comme une alternative aux carbapénèmes dans certaines situations particulières [12]. Le pivmécillinam est une pénicilline utilisée dans le cadre des infections urinaires basses. Elle garde une activité sur les entérobactéries productrices de BLSE. Elle peut avoir un intérêt dans ce type d’infection peu sévère [14].
Conclusion
Presque cent ans après la découverte de la pénicilline, les bêtalactamines sont toujours au centre de notre arsenal thérapeutique antibiotique tant en ville qu’à l’hôpital. L’origine naturelle de cette classe d’antibiotiques a néanmoins probablement favorisé l’émergence de la résistance au sein des microbiotes naturels. À chaque nouvelle molécule identifiée ou modifiée par les chimistes, un mécanisme de résistance a émergé rapidement, quand il ne préexistait pas à la commercialisation à large échelle de l’antibiotique. L’apparition des souches d’entérobactérie, de P. aeruginosa et d’Acinetobacter baumannii résistantes à toutes les bêtalactamines par production de carbapénémases constitue la dernière menace contre cette classe d’antibiotiques [1]. La mise au point de nouvelles associations ou de molécules échappant à ces enzymes doit faire face à une capacité bactérienne quasi infinie à s’adapter. Les politiques de bon usage des antibiotiques doivent être poursuivies afin d’éviter les impasses thérapeutiques qui menacent les futures générations.
Notes :
1- CTX-M : céfotaximase de type Munich.
2- VIM : Verona integron-encoded metallo-β-lactamase (métallo-bêtalactamase codée par un intégron de Vérone) ; NDM : New Delhi métallo-β-lactamase.
3- Klebsiella pneumoniae carbapenemase.
4- Oxacillinase 48.