Introduction
Un peu disparue des radars épidémiologiques au cours de la pandémie de Covid-191 (2020-2023) [1], la bactérie Mycoplasma pneumoniae a fait un retour très bruyant sur la scène internationale au cours de l’été 2023, avec notamment une épidémie d’infections respiratoires chez les enfants. Dans le cadre de la rubrique « Du côté du laboratoire », il nous a semblé utile de revenir sur le diagnostic et la prise en charge de cette infection à prédominance pédiatrique due à un agent qui reste méconnu du fait de son caractère assez « atypique », pour paraphraser la dénomination des pneumonies communautaires aiguës dites atypiques dont il est responsable.
Données bactériologiques essentielles et éléments de pathogénie
M. pneumoniae appartient au phylum des Mycoplasmatota, à la classe des Mollicutes, à la famille des Mycoplasmataceae et au genre Mycoplasma. Ces bactéries possèdent trois caractères bactériologiques très originaux : elles constituent les plus petits procaryotes dotés d’autoréplication (à la différence des virus qui utilisent la machinerie cellulaire pour se répliquer), tant par leur taille (1-2 µm de long et 0,1-0,2 µm de large) que par la taille de leur génome (0,8 million de paires de bases) ; elles sont dépourvues de paroi (d’où l’appellation Mollicutes, de « mollis cutis » qui signifie peau molle en latin) donc insensibles à tous les antibiotiques actifs sur la synthèse de ce constituant comme les bêtalactamines, les glycopeptides ou la fosfomycine ; elles peuvent se multiplier et persister à l’intérieur des cellules, même si ce n’est pas un caractère obligatoire comme pour les chlamydies ou les spirochètes, d’où la nécessité d’utiliser des antibiotiques à action intracellulaire. Ces particularités rendent compte du fait que les mycoplasmes ont été confondus avec des virus jusqu’en 1961. Isolée en 1944 sur œuf de poule embryonné par Eaton (agent d’Eaton), M. pneumoniae a été cultivée pour la première fois sur un milieu acellulaire par Chanock en 1962 [2]. Difficilement visible en microscopie optique sous forme de très petits coccobacilles ne prenant pas la coloration de Gram, M. pneumoniae apparaît en microscopie électronique comme une cellule fusiforme pourvue d’une extrémité effilée appelée pointe (de l’anglais tip) (Figure 1) [3], qui permet à la bactérie d’adhérer fortement à différents supports dont les cellules épithéliales.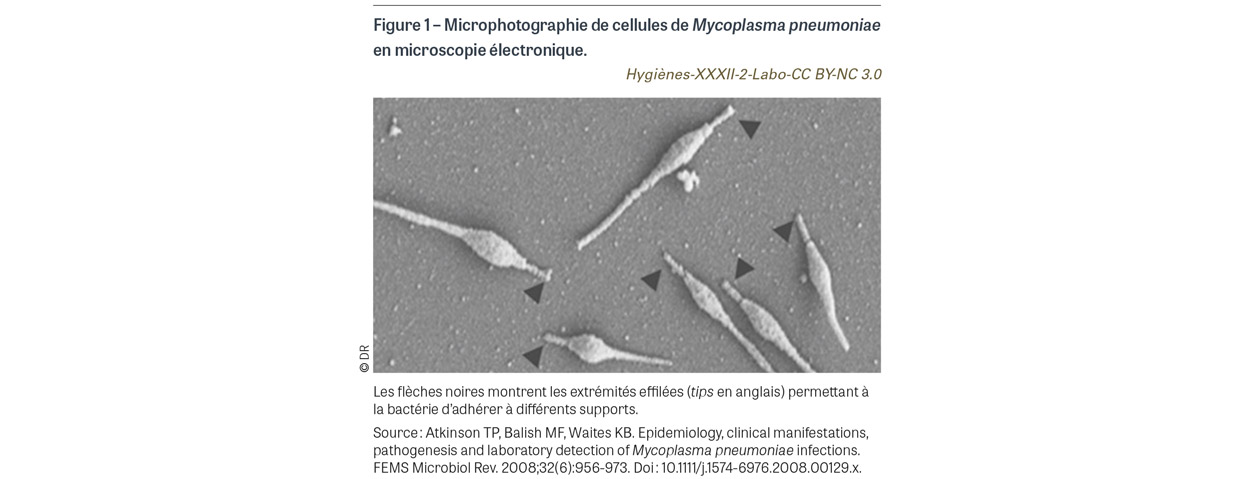
Éléments de pathogenèse
La structure principale qui intervient dans les phénomènes d’adhérence est une adhésine de 170 kDa appelée P1 qui reconnaît l’acide sialique des membranes cellulaires. L’adhérence forte de la bactérie à l’épithélium la met à l’abri de l’action du mucus et des cils vibratiles des muqueuses respiratoires, lui permettant d’échapper à la clairance mucociliaire. La bactérie paralyse les battements ciliaires des cellules épithéliales et induit la production de cytokines via l’activation de l’immunité innée [4,5]. Par ailleurs, M. pneumoniae produit un unique facteur de virulence appelé toxine CARDS (community acquired respiratory distress syndrome toxin2) [6]. Cette toxine participe à la colonisation et à l’inflammation de l’arbre respiratoire dans les formes graves de pneumonie. La bactérie peut également pénétrer dans l’épithélium respiratoire par endocytose avec une triple conséquence : établissement possible d’une infection persistante, échappement à la reconnaissance par le système immunitaire et protection vis-à-vis des agents antimicrobiens qui ne pénètrent pas dans les cellules [4,5]. Enfin, les phénomènes immunopathologiques jouent un rôle important dans la pathogénie des infections à M. pneumoniae. L’activation directe de l’immunité innée entraîne une réaction inflammatoire sur le site de l’infection avec la production de nombreuses cytokines à l’origine de lésions tissulaires au niveau du site de l’infection (poumon notamment). Quand l’immunité spécifique se développe dans les huit à dix jours suivant la primo-infection, d’autres mécanismes immunopathologiques de type indirect peuvent apparaître, avec notamment la production de complexes immuns, d’auto-anticorps (par mimétisme antigénique entre des constituants bactériens et certains tissus) ou d’agglutinines froides responsables de lésions extra-pulmonaires. Des troubles vasculaires d’origine directe, indirecte ou mixte sont également observés de type thrombose, embolie ou coagulation intravasculaire disséminée. Narita [7,8,9] a classé l’ensemble des manifestations cliniques observées dans les infections à M. pneumoniae en fonction du mécanisme pathogénique présumé (Tableau I).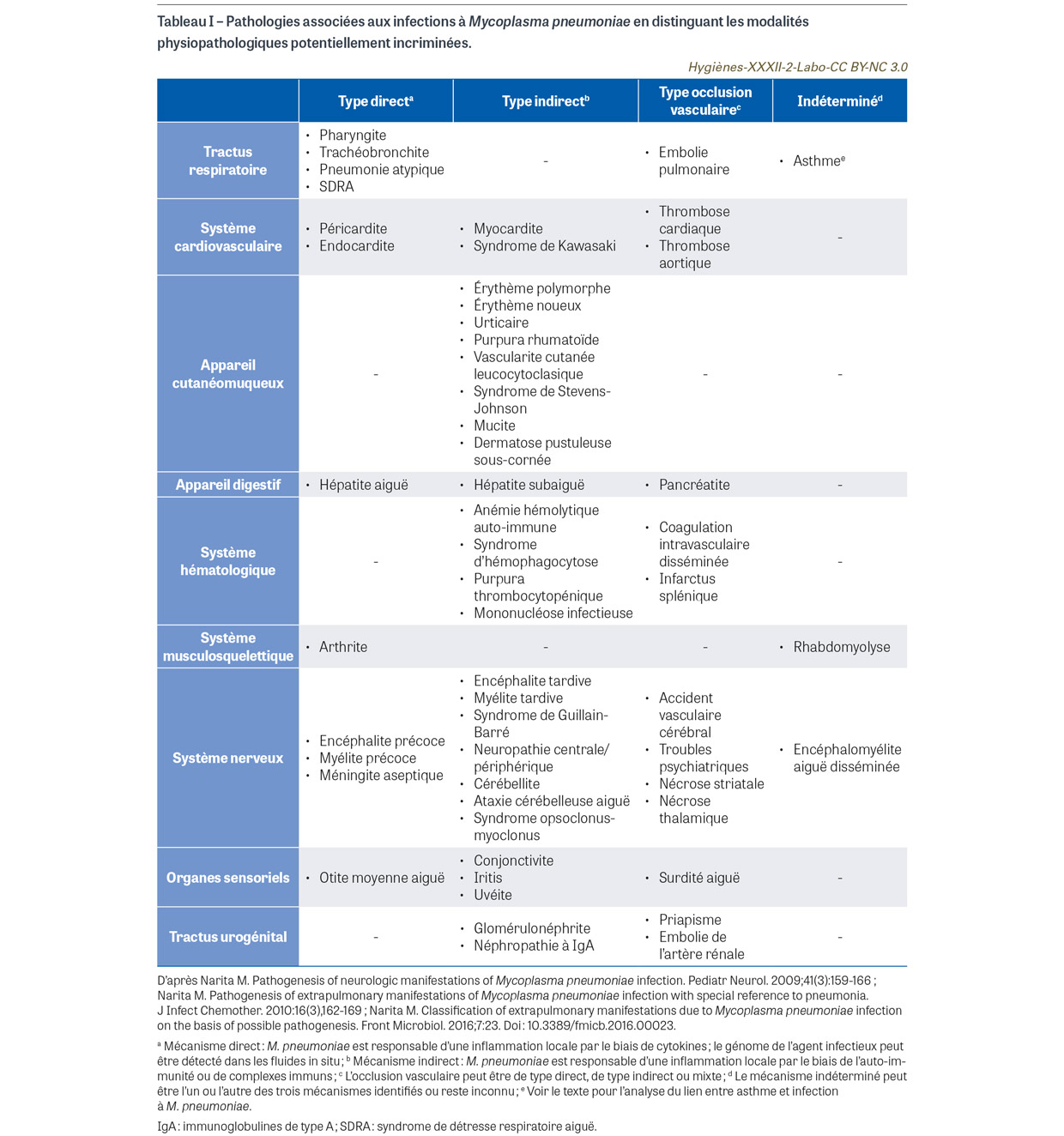
Rappel des manifestations cliniques associées à M. pneumoniae
On distingue schématiquement les manifestations respiratoires et les manifestations extra-respiratoires [10].
Manifestations respiratoires
M. pneumoniae est responsable de pharyngites, de trachéobronchites et de pneumonies communautaires aiguës. Contrairement à de nombreuses autres pathologies pulmonaires d’origine virale ou bactérienne qui prédominent au cours de la petite enfance, le pic des pneumopathies à M. pneumoniae s’observe chez les grands enfants (7-15 ans) et les adultes jeunes. La bactérie se transmet essentiellement par voie respiratoire. Après une incubation d’une à quatre semaines, les symptômes respiratoires apparaissent notamment sous forme de pneumonie « atypique » caractérisée par des opacités diffuses intéressant un ou deux poumons avec de la toux et une relative conservation de l’état général. Le terme « atypique » a été utilisé pour différencier ce type de pneumonie de la pneumonie franche lobaire aiguë systématisée observée avec les bactéries pyogènes et notamment le pneumocoque. Les aspects de pneumonies atypiques ne sont pas l’apanage des infections à M. pneumoniae mais peuvent également s’observer avec Chlamydia pneumoniae ou de nombreux virus. À l’inverse, il est possible d’observer des lésions relativement systématisées dans les infections à M. pneumoniae. Dans la tranche d’âge des grands enfants et des adultes jeunes, M. pneumoniae peut représenter jusqu’à 40% des causes de pneumonie quand cette bactérie circule de façon épidémique. À côté de ces formes de bon pronostic, il existe de rares formes fulminantes avec syndrome de détresse respiratoire aiguë [11].
Manifestations extra-respiratoires
Ces manifestations peuvent accompagner ou suivre une forme respiratoire, ce qui facilite leur diagnostic étiologique. Cependant la bactérie reste en général localisée dans l’arbre respiratoire et la plupart des atteintes extra-respiratoires « post-infectieuses » sont médiées par des mécanismes immunopathologiques indirects (auto-anticorps, immuns complexes, agglutinines froides pour les anémies hémolytiques…) ou des atteintes vasculaires à distance. De nombreux appareils peuvent être touchés (Tableau I) avec notamment des manifestations neurologiques (encéphalite ou myélite tardive, cérébellite, paralysie des nerfs crâniens, syndrome de Guillain-Barré…), hématologiques (anémie hémolytique auto-immune à agglutinines froides anti-i [12,13], purpura thrombopénique, mononucléose infectieuse…) ou dermatologiques (urticaire, érythème noueux, érythème polymorphe, purpura rhumatoïde, syndrome de Stevens-Johnson [14], dermatose pustuleuse sous-cornée [15]…). Dans ces formes associées à une atteinte respiratoire, la bactérie se multiplie surtout dans le poumon, ce qui protège les autres organes d’une atteinte directe. La question du rôle des infections à M. pneumoniae dans la constitution d’un asthme reste débattue ; s’il existe un lien statistique entre ces deux événements dans les méta-analyses [16], il est difficile de savoir quelle condition favorise l’autre, l’état inflammatoire de la muqueuse bronchique dans l’asthme pouvant aussi « faire le lit » de l’infection symptomatique par M. pneumoniae [10]. En l’absence d’infection respiratoire patente, les signes généraux peuvent se limiter à un état fébrile souvent modéré avec ou sans toux. La bactérie peut alors disséminer par voie sanguine pour atteindre d’autres organes et engendrer différentes pathologies : méningite lymphocytaire, encéphalite aiguë, péricardite, endocardite, hépatite aiguë, arthrite, otite moyenne aiguë… (Tableau I). En dehors d’un contexte épidémique marqué, le diagnostic étiologique est difficile à évoquer et les investigations étiologiques sont souvent négligées (voir le chapitre sur le diagnostic au laboratoire).
Données épidémiologiques
Dans les régions à climat tempéré, les infections à M. pneumoniae évoluent de façon endémo-
épidémique avec des pics épidémiques d’intensité très variable à intervalles de trois à sept ans sur un fond d’endémie. Ce retour régulier des épidémies est en relation avec l’immunité protectrice assez peu durable dirigée contre des régions variables de l’adhésine P1 qui constitue la cible majeure de l’immunité humorale [17]. La Figure 2 montre l’évolution des épidémies dues à M. pneumoniae au cours des dernières années. Le panneau A illustre l’évolution de l’ensemble des cas détectés par diagnostic direct ou indirect entre 2011 et 2016 dans 11 pays européens (dont la France) et Israël, avec une épidémie conséquente en 2012 [18]. Le panneau B propose la poursuite de cette surveillance entre 2017 et 2021 à partir de 37 laboratoires situés dans 21 pays sur 4 continents (seuls les résultats des tests directs sont montrés) ; les courbes montrent un effondrement du nombre de cas en 2020-2021, en relation avec les mesures de protection et de confinement prises à l’occasion de la pandémie de Covid-19 [19]. Le panneau C montre la poursuite de la surveillance épidémiologique en France à partir du réseau Renal qui regroupe une quarantaine de laboratoires hospitaliers répartis sur le territoire hexagonal fournissant des statistiques hebdomadaires d’infections respiratoires dépistées par agent infectieux à l’aide de tests directs [20]. Le panneau D montre le même type de données à partir de la surveillance des infections respiratoires dans la région de Saint-Étienne. Ces deux derniers panneaux illustrent bien la dynamique épidémiologique avec une quasi-disparition des cas entre le deuxième semestre de 2020 et le premier trimestre de 2023, puis leur ré-ascension rapide à partir du printemps 2023 sans qu’il soit encore possible de dire si le pic de l’épidémie a été atteint. Cette situation a fait l’objet d’une alerte européenne [21] et du renforcement des recommandations nationales pour la surveillance, le diagnostic et la prise en charge des cas [22,23]. À la date de rédaction de cet article, l’épidémie ne présente aucune particularité en termes de souches identifiées, de sévérité des cas ou de résistance des souches aux antibiotiques.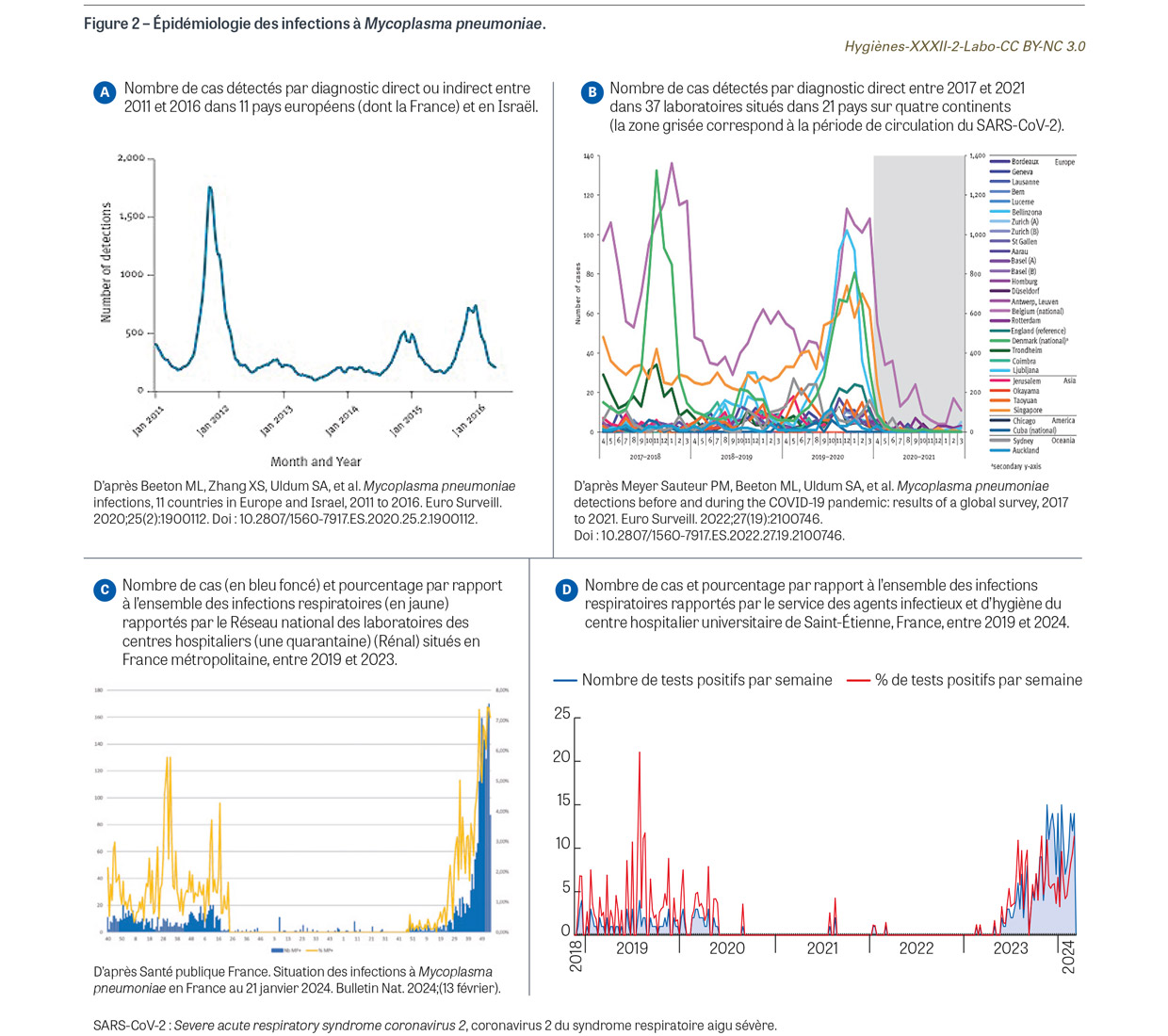
Diagnostic au laboratoire de microbiologie
Culture bactériologique
La possibilité de cultiver M. pneumoniae sur milieu inerte a représenté une étape essentielle dans la connaissance de cette bactérie [24]. Il convient d’utiliser des milieux spéciaux (milieu de Hayflick ou milieu SP4) enrichis en sérum de poulain et en extrait de levure. L’incubation a lieu sous atmosphère enrichie en CO2. La lecture de la croissance se fait par virage de l’indicateur coloré témoignant de l’acidification du milieu par fermentation du glucose pour les bouillons, et au microscope inversé ou à la loupe binoculaire à la recherche de petites colonies d’aspect granulaire (Figure 3) au terme de trois à six semaines de culture pour les milieux solides. L’identification au niveau de l’espèce, pour différencier M. pneumoniae des espèces de mycoplasmes commensales de la flore pulmonaire, est désormais faite par technique PCR3 ou plus rarement par MALDI-TOF4. La technique de culture, lente et laborieuse, est réservée aux laboratoires de référence, notamment dans le cadre de travaux sur la résistance aux macrolides (voir infra).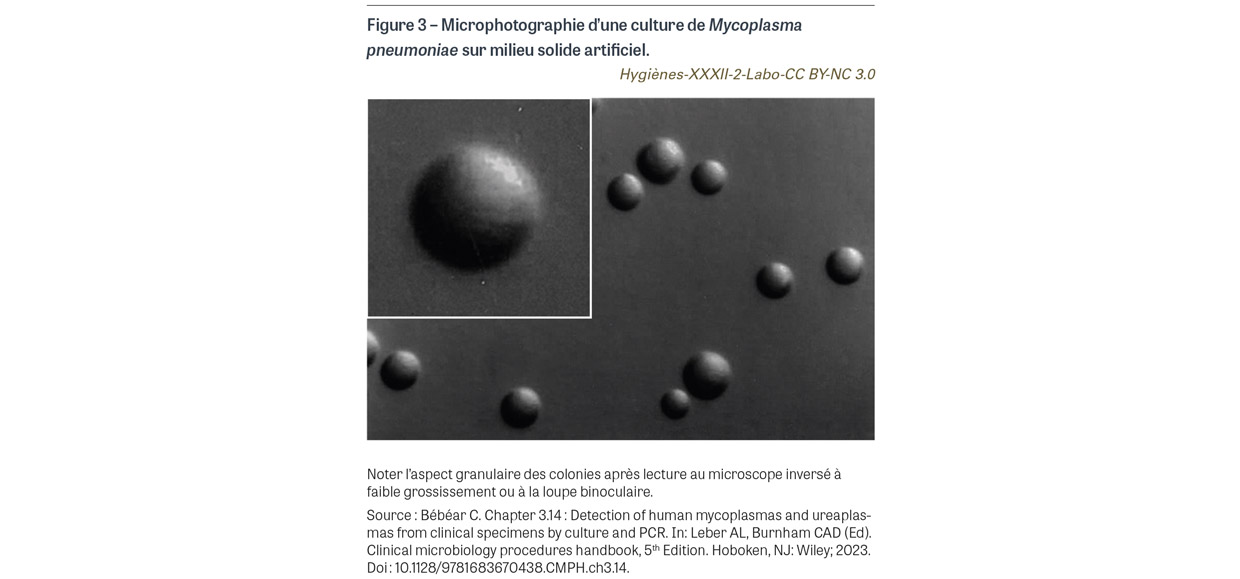
Tests d’amplification génique
Si l’on exclut quelques tests antigéniques peu sensibles et non disponibles en France, le diagnostic des infections dans lesquelles M. pneumoniae joue un rôle direct (infections respiratoires, péricardites, méningites…) se fait désormais par des techniques d’amplification génique à partir de fluides biologiques en rapport avec le site de l’infection : sécrétions nasopharyngées ou oropharyngées, expectoration induite (très sensible du fait de charges bactériennes plus élevées qu’à l’étage supérieur du tractus respiratoire), sécrétions recueillies par aspiration trachéale ou par brossage bronchique, liquide de lavage broncho-alvéolaire, liquide d’épanchement pleural ou péricardique, liquide cérébro-spinal, sang total… [24,25]. Toutes les techniques d’amplification génique sont utilisables, même si la PCR quantitative en temps réel (qPCR) est la plus utilisée [24,25]. Différentes cibles spécifiques de M. pneumoniae peuvent être choisies : gène de l’adhésine P1, gène de la toxine CARDS, gènes codant l’ARNr5 16S ou l’ARNr 23S [24]. Quelques trousses monoplex (c’est-à-dire testant uniquement M. pneumoniae) sont disponibles sur le marché [24,25,26,27,28]. D’autres trousses dites multiplex testent simultanément plusieurs pathogènes, qu’il s’agisse de bactéries à tropisme respiratoire (M. pneumoniae, C. pneumoniae avec ou sans Legionella sp.) [25,29,30,31] ou de panels de bactéries et de virus respiratoires [24,25,28,32,33]. Bien que plus coûteux et peut-être un peu moins sensibles, ces tests ont l’avantage de détecter toute une série de pathogènes, ce qui permet d’élucider la cause de l’infection, le plus souvent virale, surtout en période de faible circulation de M. pneumoniae [33]. Quels que soient la technique et le format utilisés, les tests d’amplification génique sont devenus la référence pour le diagnostic rapide des infections aiguës à M. pneumoniae. Pourtant, à la date de rédaction de cet article (avril 2024), aucun test d’amplification génique ciblant des pathogènes respiratoires (bactéries ou virus) n’est remboursé par l’assurance maladie hormis pour le SARS-CoV-26, ce qui n’est pas sans poser des problèmes de prise en charge des patients en consultation ou hospitalisés en secteur privé. Un avis de la Haute Autorité de santé est en cours de discussion ; il permettrait de faire évoluer cette situation.
Tests sérologiques
D’utilisation très ancienne, les tests sérologiques sont relativement performants pour faire le diagnostic d’une infection récente, soit par la mise en évidence d’anticorps de classe IgM7 anti-M. pneumoniae, soit par la documentation d’une séroconversion ou d’une ascension du taux des anticorps à partir de deux sérums prélevés à 10-15 jours d’intervalle et testés simultanément. De nombreuses technologies disponibles dans le commerce peuvent être utilisées [34]. Les tests d’immuno-enzymologie sont les plus répandus, notamment du fait de la possibilité de les automatiser et de rechercher en parallèle les anticorps de classes IgM et IgG. Leur coût est modeste, mais ils sont peu performants pour documenter une infection débutante au cours de laquelle la réponse immune spécifique n’est pas encore en place [35]. Par ailleurs, la présence d’anticorps de classe IgM nécessite souvent d’être confirmée par un sérum tardif montrant une évolution dynamique des anticorps, car il n’est pas rare d’observer des faux positifs ou des activations polyclonales avec positivité de tests IgM pour plusieurs pathogènes (dont notamment le virus d’Epstein-Barr, le cytomégalovirus ou les sérologies tréponémiques). En revanche, la sérologie est nécessaire pour documenter les manifestations extra-pulmonaires, tout spécialement en l’absence de manifestations respiratoires. Dans les infections neurologiques même aiguës, il est exceptionnel de détecter le génome bactérien dans le liquide cérébro-spinal et la détection d’une production intrathécale d’anticorps revêt une importance capitale pour incriminer le rôle de M. pneumoniae dans la pathologie observée. Contrairement aux tests diagnostiques directs, la sérologie M. pneumoniae fait l’objet d’une prise en charge par l’assurance maladie.
Interprétation et indications des tests
On peut schématiquement distinguer trois situations cliniques : un tableau d’infection pulmonaire isolée, un tableau d’infection pulmonaire associé à des manifestations extra-respiratoires et un tableau de manifestations extra-respiratoires sans signe respiratoire. Des algorithmes schématisent la démarche diagnostique de première intention et l’interprétation probabiliste des données (à affiner bien évidemment en fonction du tableau clinique personnalisé) (Figure 4).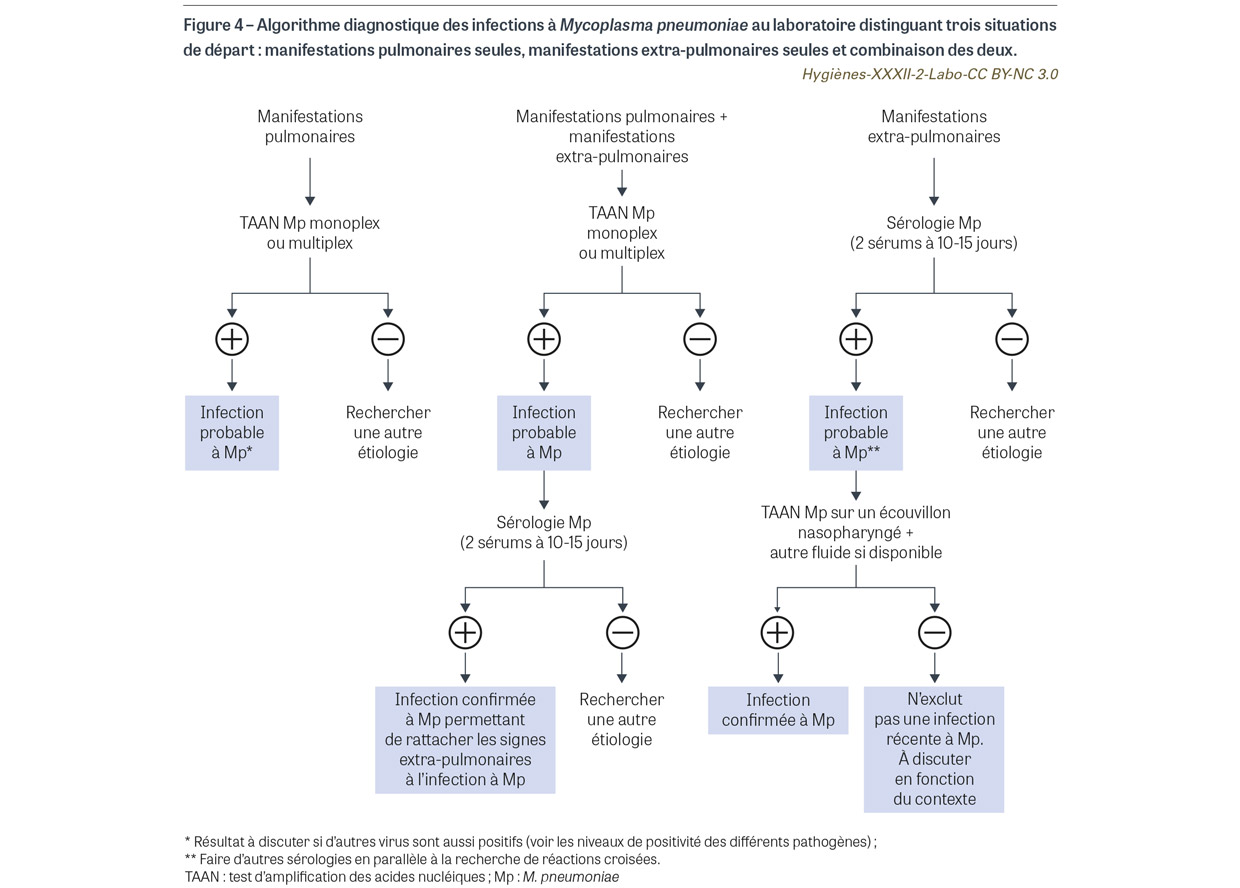
Sensibilité de M. pneumoniae aux antibiotiques
Résistance naturelle des souches de M. pneumoniae
Du fait de l’absence de paroi, tous les mycoplasmes sont naturellement résistants aux antibiotiques actifs sur la synthèse du peptidoglycane, à savoir les bêtalactamines, les glycopeptides et la fosfomycine. De plus, suite à une mutation naturelle du gène rpoB de la sous-unité bêta de l’ARN-polymérase, ils sont naturellement résistants aux polymyxines, aux sulfamides, au triméthoprime, à l’acide nalidixique et à la rifampicine [5]. Par ailleurs, l’espèce M. pneumoniae est naturellement résistante au linézolide et peu sensible à la lincomycine. Les antibiotiques habituellement actifs sur M. pneumoniae sont des molécules actives sur les bactéries intracellulaires, à savoir les macrolides et dérivés (streptogramines et kétolides), les tétracyclines et les fluoroquinolones. Compte tenu des contre-indications des deux dernières familles chez l’enfant, les macrolides représentent le traitement de choix dans cette tranche d’âge.
Résistance acquise de M. pneumoniae aux macrolides
Exceptionnelles avant les années 2000, les résistances acquises aux macrolides ont émergé au Japon et se sont rapidement étendues à la Chine ; dans cette région du monde, les taux de résistance dépassent 50% et peuvent atteindre 90% [36]. Au Moyen-Orient, les résistances acquises aux macrolides vont de 20% à 30% et, en Amérique du Nord, de 12% à 15% [5,37]. En Europe, les taux de résistance aux macrolides sont très variables avec un gradient nord-sud : de 0-4% en Hollande, en Suisse, en Allemagne ou dans les pays scandinaves à 19% en Écosse et presque 30% en Italie et en Israël [38]. En Grande-Bretagne et en France, le taux de résistance était voisin de 10% lors de l’épidémie mondiale de 2011-2012 [38,39]. Ce taux est actuellement de l’ordre de 2% en France (C. Bébéar, données personnelles in [20]). Des études longitudinales ont montré que la progression de cette résistance était liée à l’utilisation intensive des macrolides (notamment au Japon où ils représentent 30% de tous les antibiotiques utilisés par voie orale) et non à la diffusion épidémique de personne à personne d’une souche résistante à travers le monde [40]. Sous l’angle microbiologique, les macrolides et apparentés agissent en se liant à des nucléotides de l’ARN ribosomique 23S de la sous-unité 50S du ribosome bactérien, entraînant un arrêt de la synthèse des protéines par dissociation prématurée de l’ARN de transfert du ribosome. Des mutations en positions 2058, 2059, 2062 et 2611 (numérotation Escherichia coli) au niveau de l’ARN ribosomique 23S empêchent la fixation de l’antibiotique, entraînant la résistance de la souche à l’antibiotique tant in vitro qu’in vivo [36]. Pour le moment, il n’existe pas de résistance in vivo aux autres familles d’antibiotiques (fluoroquinolones et tétracyclines notamment), qui sont beaucoup moins utilisées en clinique dans cette pathologie.
Étude au laboratoire des résistances acquises aux antibiotiques de M. pneumoniae
Au laboratoire, compte tenu des difficultés pour cultiver les souches de M. pneumoniae, la mesure de la sensibilité aux antibiotiques est complexe ; la méthode de diffusion en milieu solide avec des disques imbibés d’antibiotique ne peut notamment pas être utilisée. Des recommandations ont été publiées par le Clinical Laboratory Standards Institute pour effectuer in vitro les tests de résistance aux antibiotiques [41]. Pour la résistance aux macrolides, des tests génomiques de résistance rapides permettent de détecter par des techniques PCR les mutations ponctuelles sur l’ARN ribosomique 23S mentionnées au paragraphe précédent [42,43]. De rares tests sont commercialisés pour un usage en recherche uniquement [24]. Une technique maison de PCR en temps réel a été développée par le laboratoire de bactériologie du centre hospitalier universitaire de Bordeaux ; elle est mise à la disposition des laboratoires qui transmettent des souches, notamment en cas d’échec de traitement par les macrolides au cours des infections à M. pneumoniae.
Bases du traitement des infections à M. pneumoniae
Il n’est pas du propos de cette mise au point de présenter en détail la prise en charge thérapeutique des infections à M. pneumoniae aux niveaux respiratoire et extra-respiratoire. Néanmoins, compte tenu du contexte épidémiologique actuel, nous nous ferons l’écho des recommandations rappelées par les pédiatres et les infectiologues sous l’égide de la Haute Autorité de santé pour la prise en charge ambulatoire des enfants et des adultes lorsqu’une pneumonie à M. pneumoniae est suspectée [22]. En médecine ambulatoire, il est recommandé de penser à cette étiologie devant un tableau clinique de pneumonie aiguë communautaire d’installation progressive, parfois accompagnée de signes extra-respiratoires ; cette étiologie doit être d’autant plus évoquée qu’elle continue d’évoluer au-delà de 48-72 heures malgré une antibiothérapie par bêtalactamines. Même si les pneumopathies atypiques bénignes peuvent guérir spontanément (comme les formes d’origine virale), une antibiothérapie probabiliste par macrolides est recommandée sans attendre le résultat de la radiographie thoracique, nécessaire cependant pour étayer le diagnostic et exclure certaines complications comme un épanchement, et sans prescrire de sérologie spécifique dont la négativité n’exclurait pas le diagnostic. L’état clinique doit s’améliorer dans les 48-72 heures, même si la toux peut durer plus longtemps. En l’absence d’amélioration, une hospitalisation peut se discuter sur les mêmes critères cliniques que pour les autres pneumopathies. Il est recommandé au patient et aux professionnels de santé de porter un masque à usage médical pour éviter la dissémination de l’infection [22,23]. On rappelle la difficulté de pouvoir recourir à un test de confirmation par amplification génique du fait de l’absence de prise en charge de ces tests en ambulatoire par l’assurance maladie. Si le patient consulte à l’hôpital, l’algorithme proposé (Figure 4) peut s’appliquer, ce qui a l’avantage, en cas de résultat négatif, d’épargner des traitements inutiles par macrolides dont le risque est d’accroître le taux de résistance, d’autant que le résultat de certains tests multiplex peut être obtenu dans un délai rapide. Les formes graves, les formes extra-respiratoires, les formes compliquées et celles survenant sur un terrain fragile doivent faire l’objet d’une prise en charge hospitalière personnalisée. Les antibiotiques à utiliser en première intention aussi bien chez l’enfant que chez l’adulte restent les macrolides par voie orale avec une préférence pour la clarithromycine ou l’azithromycine. En cas d’allergie, on peut prescrire de la pristinamycine ou de la doxycycline chez l’enfant à partir de huit ans. Les fluoroquinolones (lévofloxacine), contre-indiquées chez l’enfant, sont à discuter en troisième intention, notamment dans les formes neurologiques. En cas d’échec du traitement de première intention après 48-72 heures, une réévaluation est indispensable ; une recherche de résistance de la souche aux macrolides peut être justifiée. Enfin, malgré quelques tentatives, notamment à partir de la protéine P1, il n’existe pas de prévention vaccinale disponible.
Prévention de la transmission croisée
La Société française d’hygiène hospitalière a émis un avis le 8 décembre 2023 sur les conditions de prise en charge d’un patient chez lequel est suspectée ou diagnostiquée une infection par M. pneumoniae [23]. Les précautions complémentaires respiratoires de type « gouttelettes » doivent être mises en place, incluant la prise en charge en chambre individuelle, le port de masque à usage médical par les professionnels à l’entrée dans la chambre et par le patient ou résident à partir du moment où il n’est plus seul dans la chambre, et le port d’un masque FFP28 et de lunettes de protection par les professionnels pour toute manœuvre à risque majeur d’aérosolisation des sécrétions respiratoires. Ces précautions peuvent être levées à partir d’un délai minimum de 72 heures de traitement antibiotique efficace. Il est important de rappeler qu’une toux résiduelle peut persister plusieurs semaines mais cela ne doit pas conduire à maintenir les précautions complémentaires ni à réaliser de nouveaux tests diagnostiques dont l’utilité pour évaluer la contagiosité n’est pas établie. Il est nécessaire néanmoins de différencier cette toux résiduelle d’un authentique échec thérapeutique lié à une souche résistante au traitement prescrit.
Conclusion
Les mesures préventives de distanciation adoptées pendant la pandémie de Covid-19 ont entraîné la raréfaction de la circulation de nombreux pathogènes transmis par voie respiratoire. M. pneumoniae n’échappe pas à cette règle, même si cette bactérie n’est pas « partie pour toujours » [1], comme l’illustre la reprise épidémique observée dès la fin du printemps 2023. C’est l’occasion de rappeler le comportement inhabituel de ce très petit micro-organisme, plus proche par certains aspects de celui des virus que des procaryotes. Les manifestations cliniques sont très polymorphes et parfois difficiles à rattacher à l’agent causal. Le laboratoire propose désormais des tests d’amplification génique qui sont sensibles et spécifiques ; quand ils sont multiplexés à d’autres agents bactériens et viraux, ils sont très utiles pour établir un diagnostic syndromique. L’augmentation de la résistance de M. pneumoniae aux macrolides commence à devenir préoccupante à l’échelle mondiale. La disponibilité en médecine ambulatoire des tests moléculaires évoqués précédemment permettrait une rationalisation de l’antibiothérapie des pneumopathies en prescrivant des macrolides plutôt que des bêtalactamines en cas d’infection à bactérie atypique et en s’abstenant de traitement antibiotique en cas de pneumopathie virale.
Notes :
1- Coronavirus disease 2019, maladie à coronavirus 2019.
2- Toxine du syndrome de détresse respiratoire acquis dans la communauté.
3- Polymerase chain reaction, amplification en chaîne par polymérase.
4- Matrix assisted laser desorption ionization - Time of flight, spectromètre de masse couplant une source d'ionisation laser assistée par une matrice et un analyseur à temps de vol.
5- Acide ribonucléique ribosomique.
6- Severe acute respiratory syndrome coronavirus 2, coronavirus 2 du syndrome respiratoire aigu sévère.
7- Immunoglobuline de type M.
8- Filtering facepiece, masque filtrant ; la classe 2 filtre 94% des virus et aérosols.