Introduction
Dans cet article, nous souhaitons revenir sur le diagnostic virologique des viroses respiratoires. Ce choix éditorial est dicté par une triple actualité : il s’inscrit dans l’ère post-Covid-191 qui a représenté un tournant majeur dans l’épidémiologie mondiale du XXIe siècle, avec l’émergence d’un nouveau coronavirus dénommé SARS-CoV-22 qui a eu un impact majeur en santé publique entre 2019 et 2023 ; il fait également écho à la quadruple épidémie qui a marqué la saison hivernale 2022-2023 avec la circulation concomitante ou successive de virus respiratoires d’importance majeure : les différents sous-variants de la souche Omicron de SARS-CoV-2 à l’origine de nombreux cas de Covid-19 présentant une très grande transmissibilité, même si la gravité des cas a été considérablement atténuée du fait d’un changement de tropisme de ce variant désormais essentiellement responsable d’infections du tractus respiratoire supérieur, le virus respiratoire syncytial (RSV) à l’origine d’une épidémie de grande ampleur aux deux extrêmes de la vie (enfants de moins de deux ans et personnes âgées fragiles), le virus influenza A avec circulation majoritaire de la souche A/H3N23, et le virus influenza B, souche Victoria ; il s’appuie sur le changement de doctrine dans la surveillance, le diagnostic et la prise en charge des viroses respiratoires insufflé par les nouvelles recommandations du Haut Conseil de la santé publique (HCSP) édictées fin août 2023 [1], qui préconisent une approche syndromique des viroses respiratoires saisonnières.
2022-2023 : saison de tous les dangers pour les viroses respiratoires
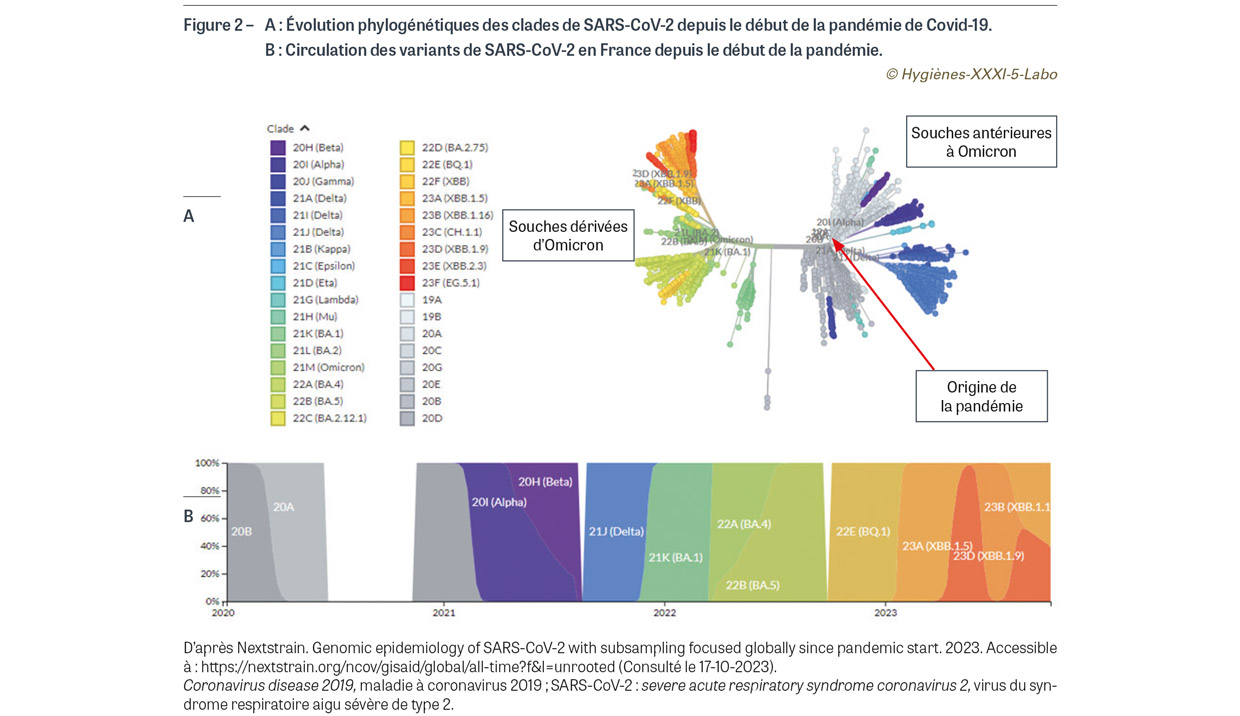
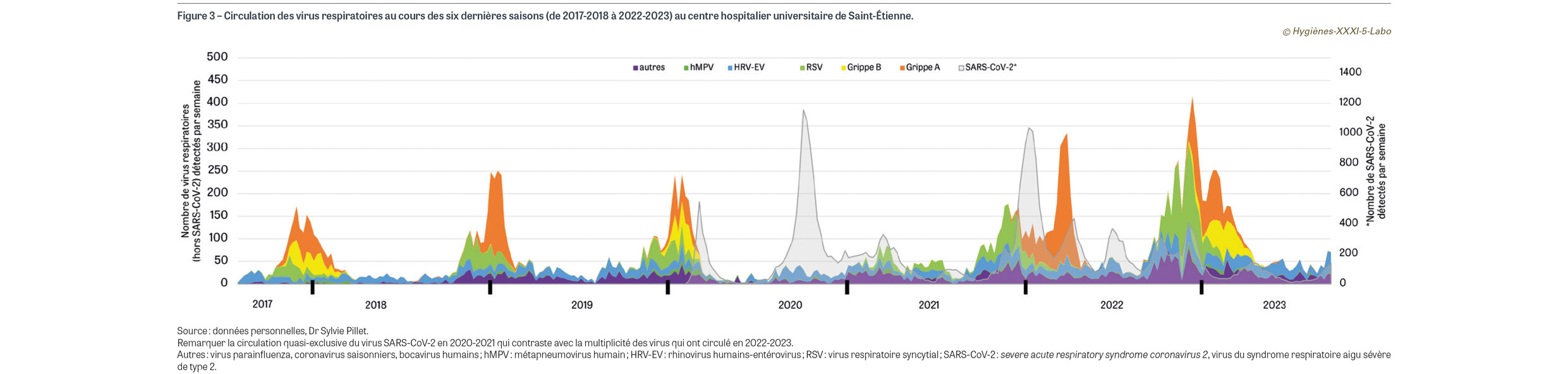
La saison automno-hivernale 2022-2023 étendue au printemps 2023 a été exceptionnelle en termes de circulation virale en France métropolitaine. L’épidémie de bronchiolite chez les jeunes enfants de moins de deux ans a débuté dès la première semaine d’octobre 2022, le pic ayant été atteint début décembre 2022 ; elle s’est achevée fin janvier 2023. Comme la saison précédente, le début d’épidémie a été précoce (six semaines plus tôt qu’observé en moyenne sur la période 2015-2020) et sa durée a été prolongée (seize semaines versus douze semaines en moyenne pendant la période 2015-2020). Quelque 73 000 passages pour bronchiolite ont été enregistrés dans les services d’urgence, dont plus d’un tiers a donné lieu à une hospitalisation [2]. Chez les personnes âgées et fragiles, le RSV est également à l’origine d’un nombre substantiel d’infections sévères du tractus respiratoire inférieur, notamment chez les sujets porteurs de pathologies cardiovasculaires [3]. En parallèle, l’épidémie de grippe saisonnière a été exceptionnellement longue (plus de quatre mois) et précoce, avec deux vagues successives bien distinctes, la première avec un début dès mi-novembre 2022 et un pic fin décembre 2022, principalement due au virus influenza A (80% de souches A/H3N2 versus 20% de souches A/H1N1pdm094), et la seconde moins intense mais très prolongée qui a débuté fin janvier 2023 et s’est étirée jusqu’à début avril 2023. Cette seconde vague a été dominée par le virus influenza B souche Victoria, même si les deux souches de virus A ont continué à circuler à bas bruit (Figure 1). En termes de mortalité, environ 1 500 décès directs5 ont été attribués à la grippe (1% de l’ensemble des décès de la période) [4], ce qui place la saison grippale 2022-2023 au même niveau que la saison 2016-2017, juste derrière la saison 2018-2019 qui avait été particulièrement meurtrière. Concernant le SARS-CoV-2, l’année 2022 a été marquée par l’hégémonie du variant Omicron qui, avec ses très nombreuses mutations dans la protéine de surface S (spike [épine] en anglais), a complètement éteint la circulation des autres variants (Figure 2A). Ce variant se caractérise par une grande transmissibilité mais surtout par un faible pouvoir pathogène, avec une majorité d’infections du tractus respiratoire supérieur du même type que celles observées avec les autres coronavirus saisonniers. Au cours des neuf premiers mois de 2022, on a assisté à une succession de « vaguelettes » épidémiques impliquant différents sous-variants de la lignée Omicron : BA.1, BA.4 et BA.5. À partir de l’automne 2022 a émergé le variant BQ.1, remplacé dès début 2023 par le variant XBB et ses sous-variants XBB.1.5, XBB.1.9 et XBB.1.1 (Figure 2B) [5]. En septembre-octobre 2023, une nouvelle vague se dessine avec une prédominance de souches « XBB.1.5-like » (dont la souche EG.5) et BA.2.75 ; une nouvelle souche dénommée BA.2.86 présentant onze mutations dans la protéine S est en train d’émerger et pourrait assez rapidement prendre le pas sur les précédentes si elle présente un avantage compétitif. Toutes ces souches ont en commun une faible pathogénicité (hors patients fragiles) mais un fort potentiel épidémique. À côté de ces virus respiratoires majeurs, d’autres virus (rhinovirus, entérovirus, virus parainfluenza, métapneumovirus…) ont circulé, avec même une épidémie bactérienne de Mycoplasma pneumoniae au cours de l’été 2023. La Figure 3 montre la circulation des virus respiratoires au CHU de Saint-Étienne au cours des six dernières saisons ; à l’instar de ce qui a été observé au niveau national, la saison 2022-2023 a été marquée par la circulation d’une grande variété de virus respiratoires qui masque sur la Figure 3 celle du virus SARS-CoV-2.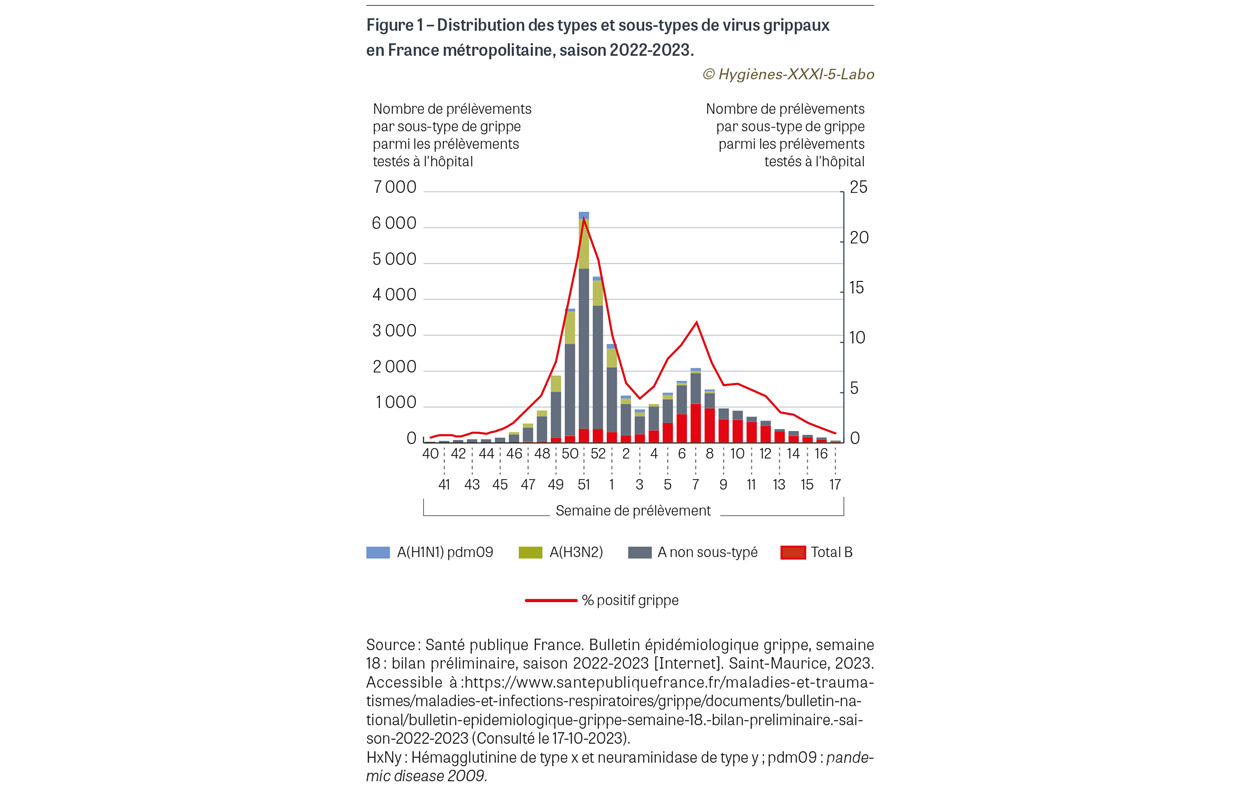
Nouvelle doctrine du Haut Conseil de la santé publique en matière de surveillance des viroses respiratoires
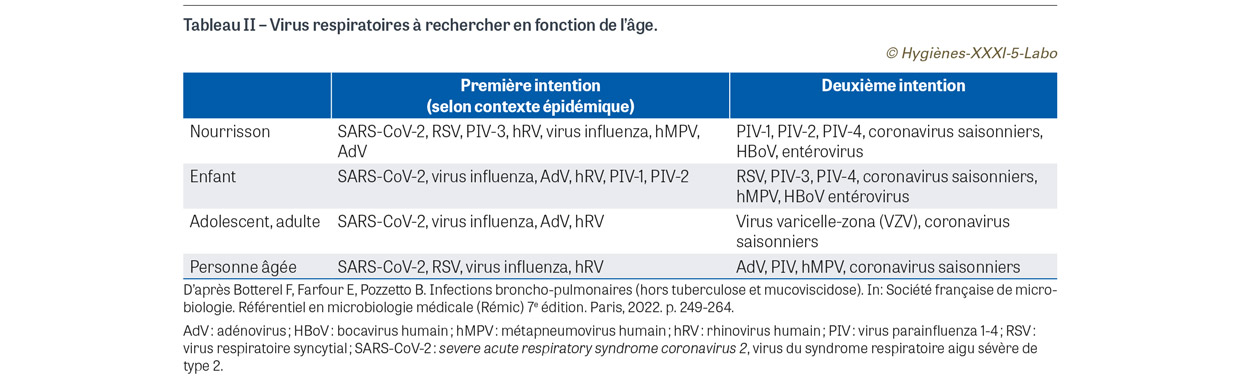
Dans son avis du 26 janvier 2023, le HCSP préconisait déjà de sortir de la situation exceptionnelle de crise de la Covid-19, de raisonner en conduite syndromique devant des manifestations cliniques évocatrices d’infection respiratoire virale, et de promouvoir dans la population générale de nouvelles règles « universelles d’hygiène respiratoire » post-Covid-19, en particulier en période épidémique hivernale [6]. Le 5 mai 2023, l’Organisation mondiale de la santé (OMS) annonçait que « la Covid-19 ne constitu[ait] plus une urgence de santé publique de portée internationale », soulignant toutefois que « cela ne signifi[ait] pas que la maladie n’[était] plus une menace mondiale » [7]. Le rôle conjugué de l’immunité collective induite par la répétition des vaccinations et des infections naturelles et de la diminution du pouvoir pathogène des souches appartenant au lignage Omicron a transformé l’infection par le virus SARS-CoV-2 en une virose respiratoire moins agressive que celle liée à la souche historique, et à gravité moindre à l’exception des cas survenant chez des sujets très fragilisés ou fortement immunodéprimés. Selon le nouvel avis du HCSP daté du 31 août 2023 [1], il semble dorénavant essentiel de proposer des mesures sanitaires adaptées à l’ensemble des virus à tropisme respiratoire puisqu’ils partagent de grandes similitudes dans leurs modes de transmission, leurs présentations cliniques, les personnes à risque de forme grave et leurs mesures de prévention. Nous reproduisons ici les deux tableaux disponibles dans cet avis relatif aux différents virus à tropisme respiratoire à suspecter, le premier en fonction des manifestations cliniques et le deuxième, adapté du référentiel en microbiologie médicale (Rémic) 2022 [8], en fonction de l’âge (Tableaux I et II). Cet avis définit différents niveaux de risque épidémique – faible (absence d’épidémie), modéré (phases pré ou post-épidémiques) et élevé (épidémie avérée) – et propose un certain nombre de matrices décisionnelles principalement destinées aux soignants et aux personnes en contact avec des personnes malades ou fragiles, auxquelles les lecteurs et lectrices intéressés sont enjoints de se reporter. L’objet de ces tableaux est de définir les mesures de prévention et de surveillance à adopter en fonction de la position de la personne concernée dans la chaîne de soins et du niveau de risque épidémique. Dans le cadre de cet article, nous ferons essentiellement référence aux recommandations du HCSP d’ordre diagnostique.
Le diagnostic direct des viroses respiratoires par détection génomique
Tests disponibles
Les tests de détection génomique basés sur la technique de RT-PCR6 quantitative ou des techniques équivalentes sont recommandés de façon préférentielle pour le diagnostic des infections respiratoires sévères chez les patients hospitalisés en raison de leur meilleure sensibilité [1]. Il existe des tests commerciaux pour la détection de tous les virus mentionnés dans les tableaux, de façon isolée (tests monoplex) ou associée (tests multiplex). Le niveau d’automatisation et la rapidité de réalisation sont très variables d’un test à un autre. Il existe une grande variété de tests multiplex : tests biplex associant deux des trois virus SARS-CoV-2, RSV, virus influenza ; tests triplex associant SARS-CoV-2, RSV et virus influenza ; tests quadruplex associant les mêmes virus mais avec différenciation des virus grippaux A et B ; tests multiplex qui proposent des panels d’agents infectieux beaucoup plus étendus, avec d’autres virus en plus des précédents (métapneumovirus, adénovirus, rhinovirus-entérovirus, virus parainfluenza, coronavirus saisonniers…), des bactéries atypiques (Mycoplasma pneumoniae, Chlamydia pneumoniae…), voire des bactéries pyogènes. Certains tests génomiques permettent un diagnostic rapide, de l’ordre d’une à deux heures, voire moins (pour l’infection à SARS-CoV-2 [9]) ; ils utilisent des automates qui enchaînent la phase d’extraction des acides nucléiques et la phase d’amplification. Certains de ces automates peuvent être délocalisés dans un point of care7 (POC) ou dans un service de soins (urgences, pédiatrie, gériatrie…).
Choix du test
Le choix du test à effectuer repose sur plusieurs paramètres : tableau clinique et niveau de gravité présentés par le patient, âge du patient, situation épidémique, diagnostic de première ou deuxième intention (Tableau II), prix de revient du test, modalités d’organisation du laboratoire… De façon schématique, on peut distinguer différentes situations :
- patient hospitalisé présentant un tableau clinique typique en situation épidémique : un test monoplex peut suffire (par exemple tableau fébrile en période de grippe ou bronchiolite en phase d’épidémie de RSV) ; en cas de négativité du test monoplex, un test multiplex étendu est recommandé en deuxième intention ;
- patient hospitalisé présentant une infection respiratoire aiguë hors contexte épidémique franc : un test multiplex est indiqué comportant au minimum SARS-CoV-2, RSV et virus influenza (sous réserve de circulation avérée pour les deux derniers) ; en cas de pneumonie ou de décompensation de bronchopneumopathie obstructive (BPCO), un test multiplex étendu est recommandé d’emblée ;
- patient admis aux urgences et porteur d’une infection respiratoire aiguë de gravité intermédiaire : un test multiplex « rapide » positif pour un virus respiratoire peut être déterminant pour éviter une hospitalisation ou une antibiothérapie inutile, ou encore pour prescrire un traitement spécifique adapté (nirmatrelvir et ritonavir [Paxlovid®, Pfizer, New York, NY, États-Unis] en cas d’infection à SARS-CoV-2, oseltamivir [Tamiflu®, Roche, Bâle, Suisse] ou autre en cas de grippe à la phase aiguë, ou encore macrolides en cas de pneumopathie à bactérie « atypique »).
Il est important de rappeler que la mise en place de mesures d’isolement du patient porteur d’une infection respiratoire aiguë ne doit pas attendre le résultat des tests virologiques.
Par ailleurs, les tests de détection génomique peuvent rester positifs même après résolution des signes cliniques, d’où l’importance de considérer la valeur de CT (cycle threshold8) qui permet d’évaluer grossièrement la charge virale lorsque cette valeur est disponible. Dans le cas du SARS-CoV-2, la Société française de microbiologie a défini pour chaque test des valeurs de CT permettant de refléter la contagiosité du patient [10] ; une valeur de CT élevée permet de lever l’isolement et de transférer le patient. Par ailleurs, pour les infections symptomatiques à SARS-CoV-2 de lignage Omicron hors immunodépression, il a été montré que les patients présentant une infection récidivante à SARS-CoV-2 ne sont plus contagieux au-delà du dixième jour après le début des symptômes [11]. Pour les soignants vaccinés présentant une infection symptomatique à SARS-CoV-2 en période d’intense circulation virale, une éviction prolongée est susceptible de provoquer une forte tension en milieu de soins ; c’est pourquoi le HCSP a autorisé une reprise de l’activité dès J5-J7 sous réserve d’une négativité des symptômes depuis 48 heures sans qu’il soit nécessaire de refaire un test de RT-PCR, tout en maintenant le port du masque et le strict respect des mesures barrières [12].
Cas des co-infections
Un dernier point à discuter est celui des co-infections virales, comme cela a été fréquemment observé au cours de l’hiver dernier où plusieurs épidémies se sont télescopées. Une revue de la littérature publiée entre janvier et mars 2020 a analysé la prévalence des co-infections respiratoires virales et par bactéries atypiques chez les sujets atteints de Covid-19 [13]. Dix-huit études rétrospectives de cohorte et une étude prospective ont été retenues, rassemblant 1 880 sujets infectés par le SARS-CoV-2. Le taux de co-infection variait entre 11,6% (toutes les études) et 16,8% (dans les études où 100% des sujets ont été testés pour d’autres pathogènes). Les co-pathogènes le plus souvent retrouvés étaient Mycoplasma pneumoniae (59 cas), un virus grippal A (34 cas) ou B (19 cas), Chlamydia pneumoniae (24 cas), RSV (18 cas), un rhino-entérovirus (11 cas), et un coronavirus saisonnier (10 cas). En cas de positivité de plusieurs cibles, la charge virale appréciée par la valeur de CT est déterminante : le virus responsable du tableau clinique est très vraisemblablement celui dont la valeur de CT est la plus faible ; si plusieurs virus présentent une charge virale élevée, on peut conclure à une vraie co-infection. Le HCSP rappelle que les stratégies multiplex nécessitent une évaluation médico-économique approfondie afin de mieux définir leurs indications [1]. On attend avec impatience les conclusions de la Haute Autorité de santé (HAS) dans ce domaine afin de préciser dans quelles situations ces stratégies méritent d’être recommandées et prises en charge par l’assurance maladie. Signalons enfin que les solutions techniques proposées par les industriels sont de plus en plus sophistiquées et que les progrès spectaculaires obtenus pour les tests multiplex en termes de performances, d’automatisation et de rapidité sont très prometteurs, sous réserve de bien définir leurs indications. Le coût de ces tests, qui constitue encore un obstacle à leur utilisation plus étendue, devrait baisser dans l’avenir, comme cela a été observé pour d’autres technologies (anticorps monoclonaux, tests PCR monoplex, séquençage…) autrefois réservées à la recherche hospitalière.
Diagnostic direct des viroses respiratoires par tests antigéniques : quand les faire ? Pour quels virus ? Pour quels patients ?
Infection à SARS-CoV-2
La pandémie de Covid-19 a consacré, bien que tardivement, l’intérêt des tests antigéniques pour le diagnostic « instantané » de l’infection à SARS-CoV-2. Basés principalement sur le principe de l’immunochromatographie, ces tests ont permis, au plus fort de la pandémie (de fin 2020 à fin 2021), de décupler la puissance de dépistage et de permettre à la population générale de s’approprier le contrôle de l’infection. L’ouverture de la réalisation de ces tests aux centres de soins, aux pharmacies de ville, aux écoles ou encore aux particuliers a « démocratisé » le diagnostic de l’infection, surtout quand la matrice utilisée (prélèvement nasal antérieur, salive…) s’avérait moins invasive que le classique écouvillonnage nasopharyngé. La faible sensibilité de ces tests (de l’ordre de 1 000 à 10 000 fois moindre que celle des tests génomiques) est devenue un atout dans le sens où leur fenêtre de positivité est bien corrélée au pic de charge virale donc à la contagiosité du sujet testé. C’est pourquoi l’indication des tests antigéniques SARS-CoV-2 concerne essentiellement les formes symptomatiques bénignes ambulatoires au pic des symptômes ; ils sont particulièrement adaptés pour le diagnostic de l’infection à SARS-CoV-2 chez des personnes sans facteur de risque en contact avec des patients fragiles ou immunodéprimés. Une étude récente a montré que, pour l’infection à SARS-CoV-2 à l’ère Omicron, où la plupart des individus présentent une immunité ancienne (naturelle ou vaccinale), le pic de charge virale est atteint au quatrième jour après le début des symptômes, alors que, pour la grippe, ce pic est atteint au deuxième jour ; cela peut expliquer la négativité de certains tests antigéniques SARS-CoV-2 s’ils sont effectués trop précocement [14]. La distinction entre les autotests, les tests rapides d’orientation diagnostique (Trod) et les tests antigéniques pratiqués en laboratoire d’analyse est essentiellement réglementaire. Sous l’angle technologique, il s’agit des mêmes tests. Les auto-tests sont effectués par le patient et sont à sa charge financière ; leur moindre sensibilité apparente est liée à l’auto-prélèvement, qui est souvent moins fiable que le prélèvement effectué par un tiers. Les Trod sont sous la responsabilité d’un professionnel de santé non-biologiste ; en cas de positivité, ils doivent en principe être contrôlés par un test diagnostique quel qu’il soit. Les tests antigéniques réalisés en laboratoire sont soumis à toutes les exigences d’un test biologique standard et notamment aux contrôles de qualité réglementaires.
Autres tests rapides
Des tests immunochromatographiques rapides sont également disponibles pour d’autres virus respiratoires, essentiellement les virus influenza et le RSV. Ces techniques sont habituellement très spécifiques, mais leur sensibilité reste médiocre par rapport aux techniques moléculaires de référence, allant, pour la grippe, de 50% à 85% selon le type de test [15]. En fait, la sensibilité de ces tests est très dépendante de la charge virale, beaucoup plus élevée dans les infections à RSV que dans les infections grippales, de même que dans les infections du jeune enfant par rapport à celles de l’adulte [16,17]. Dans un récent avis, la HAS a conclu que les tests rapides n’avaient pas d’intérêt en population générale à titre individuel [18]. En revanche, elle estime que, sous certaines conditions, la recherche rapide antigénique de certains virus respiratoires (Trod grippe et Covid-19, ou Trod grippe, Covid et RSV) pourrait présenter un intérêt médical à l’échelon populationnel (impact de santé publique) qui justifierait une prise en charge par la collectivité du fait d’un bénéfice potentiel pour le système de santé, les soignants, les patients et leurs familles en période hivernale, notamment en termes d’économie de traitements antibiotiques inappropriés ou de passages aux urgences non justifiés.
Autres tests à visée diagnostique : culture, sérologie, évaluation de l’immunité cellulaire…
Depuis l’avènement des tests génomiques ou antigéniques, la culture virale sur cellules permissives a pratiquement disparu des laboratoires d’analyse. Cependant la culture relativement facile du SARS-CoV-2 (bien que nécessitant des conditions de confinement de niveau 3) a permis de montrer que, hors immunodépression, la « cultivabilité », qui est probablement le meilleur marqueur de substitution pour évaluer l’infectiosité d’un prélèvement, est essentiellement corrélée à la charge virale et à la date du prélèvement par rapport au début des symptômes [19]. La sérologie des viroses respiratoires à visée diagnostique a été complètement abandonnée, au profit des tests directs décrits précédemment. En revanche, elle est très intéressante pour évaluer la production d’anticorps et notamment la production d’anticorps neutralisants en réponse aux infections naturelles ou aux immunisations vaccinales. Ces outils sérologiques sont essentiels pour évaluer le bénéfice des nouvelles approches thérapeutiques (anticorps monoclonaux « large spectre ») ou vaccinales utilisées contre le SARS-CoV-2, les virus influenza ou le RSV. Concernant le SARS-CoV-2, il est théoriquement possible de distinguer une infection naturelle d’une infection vaccinale en testant les anticorps dirigés contre la nucléocapside (antigène N absent du vaccin) des anticorps anti-S (spike) ; cependant, les anticorps anti-N9 sont parfois de courte durée, surtout lors d’infections bénignes ou asymptomatiques. Les anticorps anti-S sont plus durables et mieux corrélés avec la protection puisque la plupart des anticorps neutralisants sont dirigés contre cette protéine. Il est possible, à partir d’une sérologie anti-S, de déterminer un taux de BAU (binding antibody units10) par millilitre, qui est un reflet du niveau de protection (même s’il est impossible de fixer un taux protecteur car cette valeur évolue avec les variants, les réponses individuelles, les techniques utilisées et le temps écoulé depuis la dernière exposition naturelle ou vaccinale). Outre l’immunité humorale, la protection contre les infections repose en grande partie sur l’immunité cellulaire médiée par les lymphocytes T. L’immunité cellulaire, malgré son rôle essentiel dans la protection à long terme (mémoire immunitaire), est beaucoup plus difficile à mesurer en pratique que l’immunité basée sur la production d’anticorps spécifiques. Avec le SARS-CoV-2, il a été développé des tests réalisables en routine, basés sur la capacité de lymphocytes T spécifiques du SARS-CoV-2 à être activés lorsqu’ils ont été préalablement générés par une infection naturelle ou vaccinale ; si ces cellules sont présentes, un simple contact avec les antigènes à tester (ici des composants du SARS-CoV-2) est capable de les activer et de leur faire produire de l’interféron gamma qu’il est ensuite facile de mesurer par un test de type ELISA11 (Figure 4) [20].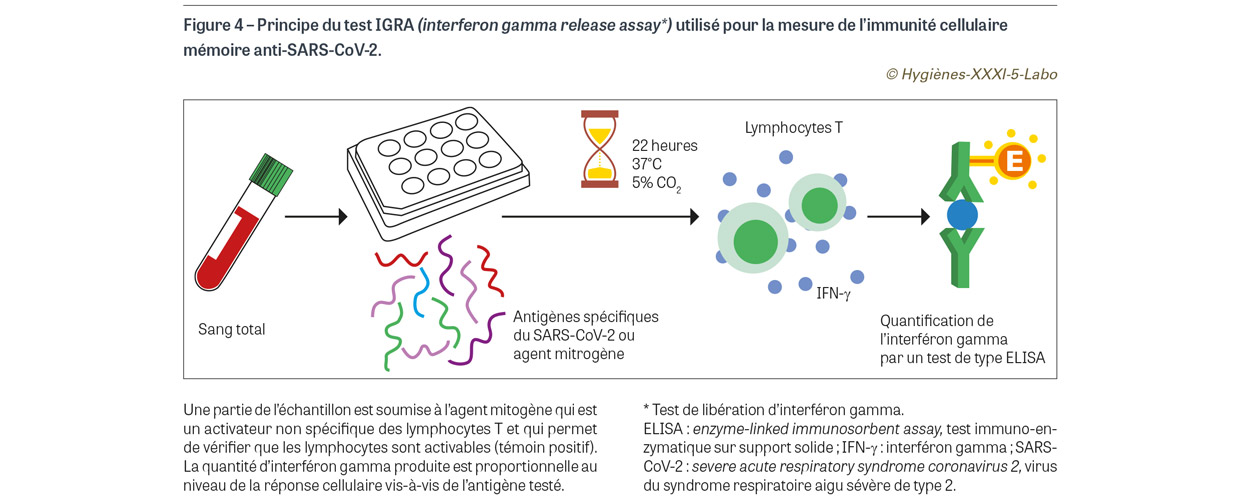
Conclusion
Même si un grand nombre de personnes, y compris dans le monde de la santé, souhaitaient revenir aux pratiques « prépandémiques », d’autres, dont une majorité d’hygiénistes, arguent de l’efficacité des mesures barrières pour les étendre en milieu de soins à l’ensemble des viroses respiratoires, au moins en période épidémique [21]. Il en va de même pour le diagnostic des viroses respiratoires, qui ne se pratiquera plus comme à l’ère pré-Covid-19 et s’adaptera à l’épidémiologie de la phase Omicron tout en bénéficiant de l’apport des tests multiplex. À la suite des recommandations du HCSP, on peut, de façon très schématique et sous réserve d’une nouvelle évolution notable de la situation épidémiologique, proposer quelques règles diagnostiques simples pour la gestion des viroses respiratoires chez les patients, les soignants et la population générale, tant en structure de santé qu’en pratique « de ville » :
- patient hospitalisé présentant un syndrome respiratoire : test génomique monoplex ou multiplex, en fonction du contexte clinico-épidémique, avec réalisation d’un panel étendu en deuxième intention en cas de négativité des premiers tests ; chez l’enfant, des tests antigéniques peuvent suffire en première intention, avec nécessité de recourir aux tests génomiques en cas de réponse initiale négative ;
- patient consultant aux urgences pour syndrome respiratoire : si le tableau est peu inquiétant, on peut se limiter à un diagnostic clinique ; en cas de décision d’hospitalisation ou d’hésitation sur la décision à prendre, le patient doit bénéficier d’un test diagnostique avec les mêmes remarques que dans le cas précédent ; cette démarche a pour objectif d’éviter les traitements antibiotiques abusifs et d’autres investigations diagnostiques inutiles en cas de résultat positif ;
- patient non-soignant consultant en ambulatoire pour syndrome respiratoire : la plupart du temps, un diagnostic étiologique n’est pas nécessaire, sauf s’il existe une discussion de traitement antibiotique (pneumopathie, décompensation de BPCO, terrain cardiovasculaire ou diabétique…) ; dans ce dernier cas, sous réserve d’un résultat rapide, un test génomique plus ou moins étendu peut être utile pour identifier l’agent responsable et éviter une antibiothérapie inutile (ou l’adapter) ;
- soignant cas contact d’un sujet porteur d’une virose respiratoire avérée ou présentant un syndrome respiratoire banal : si le tableau clinique est compatible avec le port du masque en continu, on peut surseoir au test diagnostique (en prenant soin de s’isoler aussi pour les pauses et les repas) ; dans tous les autres cas, un test génomique est souhaitable, à adapter en fonction du contexte clinico-épidémiologique, avec réalisation d’un panel étendu en deuxième intention en cas de négativité des premiers tests ;
- sujet cas contact hors soignant asymptomatique : pas d’indication de test diagnostique ; porter un masque chirurgical pendant cinq à sept jours, éviter les visites à des sujets fragiles ;
- suivi des patients infectés et placés en isolement : si le sujet est immunocompétent et vacciné, l’isolement peut être levé cinq à sept jours après le début des symptômes pour les soignants et après une dizaine de jours pour les autres patients sans nécessité de répéter le test diagnostique ; si le sujet est immunodéprimé, la décroissance de la charge virale doit être suivie par RT-PCR.
En conclusion, les nouvelles modalités diagnostiques des viroses respiratoires méritent d’être évaluées avec une méthodologie stricte afin de définir plus précisément quels agents pathogènes doivent être recherchés en priorité, chez quels patients et selon quelles modalités de remboursement par l’assurance maladie, dans le but de rationaliser la prise en charge des viroses respiratoires dans leur diversité, de mieux appliquer les gestes barrières et d’éviter les traitements antibiotiques inutiles.
Notes :
1- Coronavirus disease 2019, maladie à coronavirus 2019.
2- Severe acute respiratory syndrome coronavirus 2, virus du syndrome respiratoire aigu sévère de type 2.
3- Hémagglutinine de type 3 et neuraminidase de type 2.
4- pdm09 : pandemic disease 2009.
5- Les décès directs correspondent aux décès pour lesquels la grippe est mentionnée comme facteur causal sur le certificat de décès. Dans le cadre de cette saison marquée par plusieurs épidémies simultanées, il est difficile d’évaluer la part de la grippe dans les causes indirectes de décès (surinfection bactérienne pulmonaire ou décompensation cardiorespiratoire), notamment chez les sujets âgés.
6- Real time polymerase chain reaction, réaction de polymérisation en chaîne en temps réel.
7- Site de biologie délocalisée plus proche du patient.
8- Seuil de cycle.
9- Dirigés contre la protéine de nucléocapside.
10- Unités d’anticorps de liaison.
11- Enzyme-linked immunosorbent assay, essai d’immuno-absorption enzymatique.