Introduction
À la suite de l’éradication de la variole par la vaccination proclamée par l’Organisation mondiale de la santé (OMS) en 1977 [1], les infections à orthopoxvirus au sein de l’espèce humaine semblaient avoir rejoint la peste ou la lèpre dans la « poubelle » des grands fléaux microbiologiques du passé. La réémergence dans les années 2000 de l’infection à virus monkeypox (MPXV) chez l’humain est venue nous rappeler que les vieux phénix virologiques sont toujours prêts à renaître de leurs cendres. Il nous a semblé intéressant de brosser l’histoire de cette réémergence, connue sous le nom de variole du singe et renommée mpox par l’OMS le 28 novembre 2022, pour entériner la transmission désormais interhumaine d’un agent pathogène pourtant essentiellement zoonotique au cours des siècles passés. Après quelques considérations virologiques, épidémiologiques, cliniques, diagnostiques et thérapeutiques, nous nous attacherons à montrer les conséquences pratiques singulières de cette réémergence pour l’hygiéniste.
Connaissances virologiques de base sur les orthopoxvirus et sur le virus monkeypox
Orthopoxvirus
Le genre Orthopoxvirus rassemble un groupe de virus appartenant à la grande famille des Poxviridae qui s’inscrit elle-même dans ce qu’il est convenu d’appeler les virus géants, c’est-à-dire dont la taille du génome à ADN1 dépasse 100 000 paires de base (Figure 1A) [2]. Les particules virales, en forme de brique et pourvues d’une enveloppe (Figure 1B), mesurent environ 0,3 µm de long sur 0,2 µm de large, soit la taille des plus petites bactéries comme les mycoplasmes, ce qui les rend visibles avec de bons microscopes photoniques. Les virus de la famille des Poxviridae peuvent infecter des insectes (sous-famille des Entomopoxvirinae) ou des oiseaux et des mammifères (sous-famille des Chordopoxvirinae). Cette dernière sous-famille renferme quatre genres dont trois sont pathogènes pour l’humain : Orthopoxvirus, Parapoxvirus et Molluscipoxvirus. Les orthopoxvirus comportent un grand nombre d’espèces susceptibles d’infecter les mammifères ; les plus importantes sont le virus de la variole (Variola virus ou VARV), qui a tué des centaines de millions d’individus au cours de l’histoire de l’humanité et qui est considéré comme éradiqué de la planète depuis 1977, le virus de la vaccine (Vaccinia virus ou VACV), dérivé de souches équines et bovines de poxvirus et utilisé pour la vaccination antivariolique à partir des travaux de Jenner à la fin du XVIIIe siècle, le virus horsepox (HPXV), ancêtre du virus de la vaccine qui contaminait les chevaux et qui a aujourd’hui disparu, le virus cowpox (CPXV), autre ancêtre du virus de la vaccine et qui continue à infecter les bovidés et parfois les humains, le virus camelpox (CMXV) qui infecte les chameaux et ponctuellement les humains, le virus de l’ectromélie (ECTV) qui contamine les souris, et le virus monkeypox (MPXV) qui fait l’objet de cet article. Tous les orthopoxvirus possèdent un génome linéaire à ADN double brin de 170 000 à 240 000 paires de base, avec une région centrale très conservée au sein du genre. Les deux télomères situés aux extrémités du génome forment des structures en épingle à cheveux fermées de façon covalente. Les régions les plus terminales du génome comportent des séquences inversées répétées (ITR pour inverted terminal repeats) dont la taille varie selon les espèces (Figure 1C). Il est très important de retenir qu’il existe une immunité croisée entre toutes ces espèces du fait d’une grande parenté antigénique entre elles, ce qui a été à l’origine du succès de la vaccination jennérienne pour éradiquer la variole et de l’utilisation des vaccins contre la variole pour prévenir la mpox.
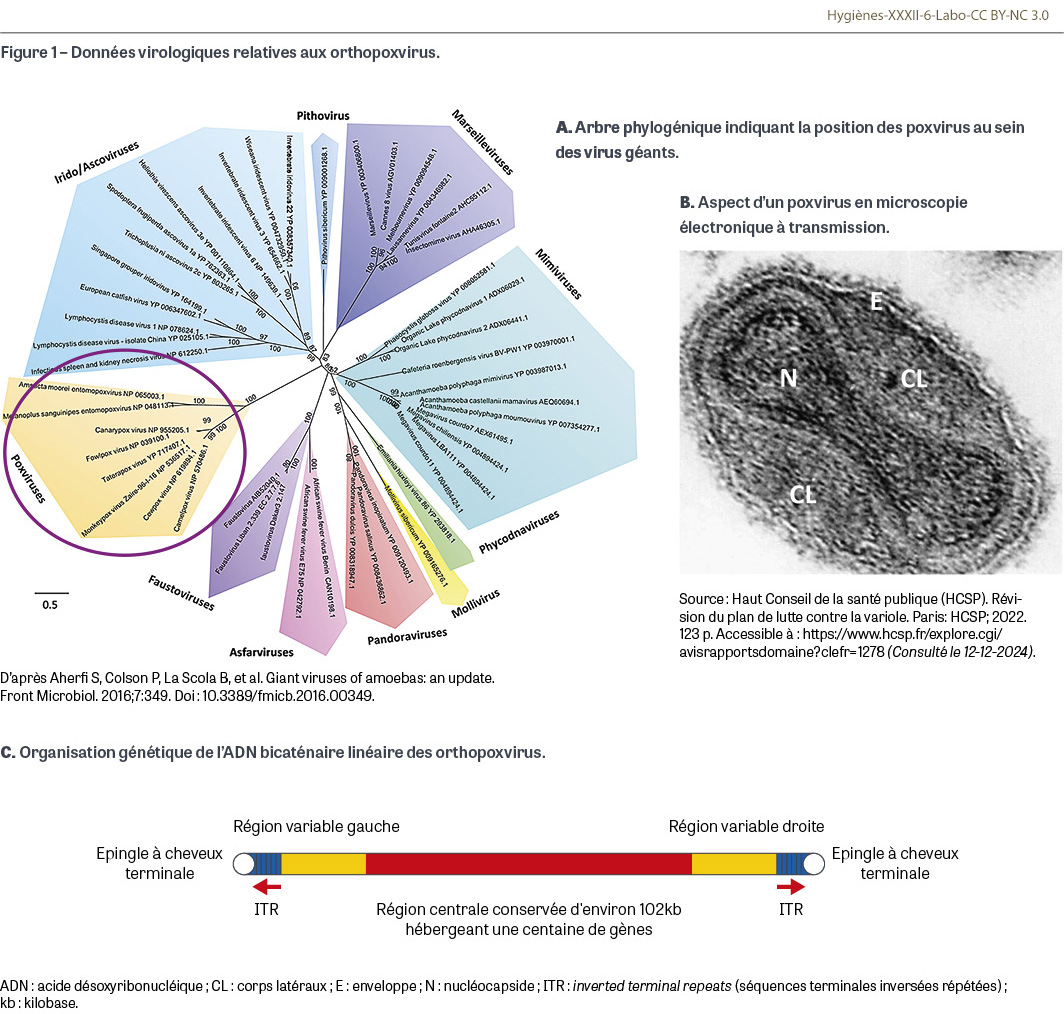
Virus monkeypox
Le MPXV tient son nom du fait qu’il a été isolé pour la première fois en 1958 au cours d’une épidémie chez des macaques en captivité présentant une éruption vésiculeuse varioliforme [3]. Dans l’espèce humaine, il a été isolé pour la première fois en 1970 en République démocratique du Congo (RDC) chez un enfant de neuf mois présentant une éruption vésiculeuse [4]. Depuis l’éradication de la variole, l’infection à MPXV est devenue la plus prévalente des orthopoxviroses chez l’humain. Le réservoir animal de MPXV est très diversifié. Essentiellement présent sur le continent africain dans la faune sauvage, il concerne de très nombreux mammifères (loirs, écureuils, souris rayées, rats géants de Gambie, gerboises, hérissons, musaraignes-éléphants, chinchillas, porcs-épics, tamanoirs, marmottes, opossums, sangliers…). Les primates non humains peuvent être contaminés accidentellement comme les humains (singes verts mangabeys, singes à queue rouge, singes colobes, cercopithèques, macaques, orangs-outans, gorilles, chimpanzés…). Depuis les années 1970, deux clades de MPXV génétiquement distincts ont été décrits : le clade I du bassin du Congo (Afrique centrale) et le clade II d’Afrique de l’Ouest. Le clade du bassin du Congo est plus répandu que celui d’Afrique de l’Ouest et a été décrit dans le cadre de transmissions interhumaines, à la différence de celui d’Afrique de l’Ouest pour lequel la transmission était essentiellement d’origine animale (pour les cas documentés) jusqu’en 2022 [5].
Modes de transmission du virus monkeypox à l’humain et épidémiologie
Bien que MPXV soit avant tout un virus zoonique, depuis quelques années, sa capacité à se transmettre de manière interhumaine s’accroît, ce qui a donné lieu à deux alertes internationales en 2022 avec le clade IIb puis en 2024 avec le clade Ib. À ce titre, nous pouvons considérer que, à l’image de ce que nous avons connu pour la variole il y a des milliers d’années, nous assistons, depuis l’éradication du virus de la variole, à son remplacement par le MPXV parmi les orthopoxviroses à transmission interhumaine. En effet, du fait de l’arrêt de la vaccination contre la variole en Afrique, l’immunité contre les orthopoxvirus ne cesse de reculer et les jeunes générations sont particulièrement exposées à de nouvelles contaminations. Par exemple, en RDC, le nombre déclaré d’infections à mpox est passé de 38 entre 1970 et 1979 à 343 entre 1980 et 1989, 511 entre 1990 et 1999, 10 027 entre 2000 et 2009, et 18 788 entre 2010 et 2019 [6].
Transmission zoonotique
La transmission zoonotique est le mode de contamination historique des humains, encore prédominant de nos jours, notamment chez les enfants. La contamination peut se faire par morsure ou griffure par un animal sauvage réservoir du MPXV, notamment des rongeurs (voir plus haut), par contact direct avec des fluides corporels ou des carcasses provenant d’animaux infectés ou par des contacts indirects avec des squames présentes dans l’environnement (litière, nid…). La préparation de viande de brousse, souvent citée, est anecdotique car la cuisson détruit l’infectiosité virale.
Transmission interhumaine
L’intensification de la transmission interhumaine au cours des dernières années est au cœur des préoccupations des épidémiologistes. Il est possible de distinguer schématiquement trois époques.
- Avant les années 2020, les transmissions interhumaines restaient limitées à des clusters de taille réduite, notamment au niveau intrafamilial, sur le continent africain, essentiellement avec le clade I du bassin du Congo réputé plus pathogène et plus transmissible [5,6]. Hors d’Afrique, il a été identifié un seul cluster d’infection à MPXV, en 2003 aux États-Unis : des chiens de prairie (rongeurs du genre Cynomys) ont été contaminés accidentellement par des rats de Gambie ou des loirs importés illégalement d’Afrique, ce qui a été à l’origine d’un foyer de 71 cas humains groupés d’infections à MPXV, essentiellement des enfants : la majorité des cas a été infectée directement par des chiens de prairie utilisés comme animaux de compagnie ; quelques cas de transmission interhumaine ont été suspectés mais non prouvés [7,8].
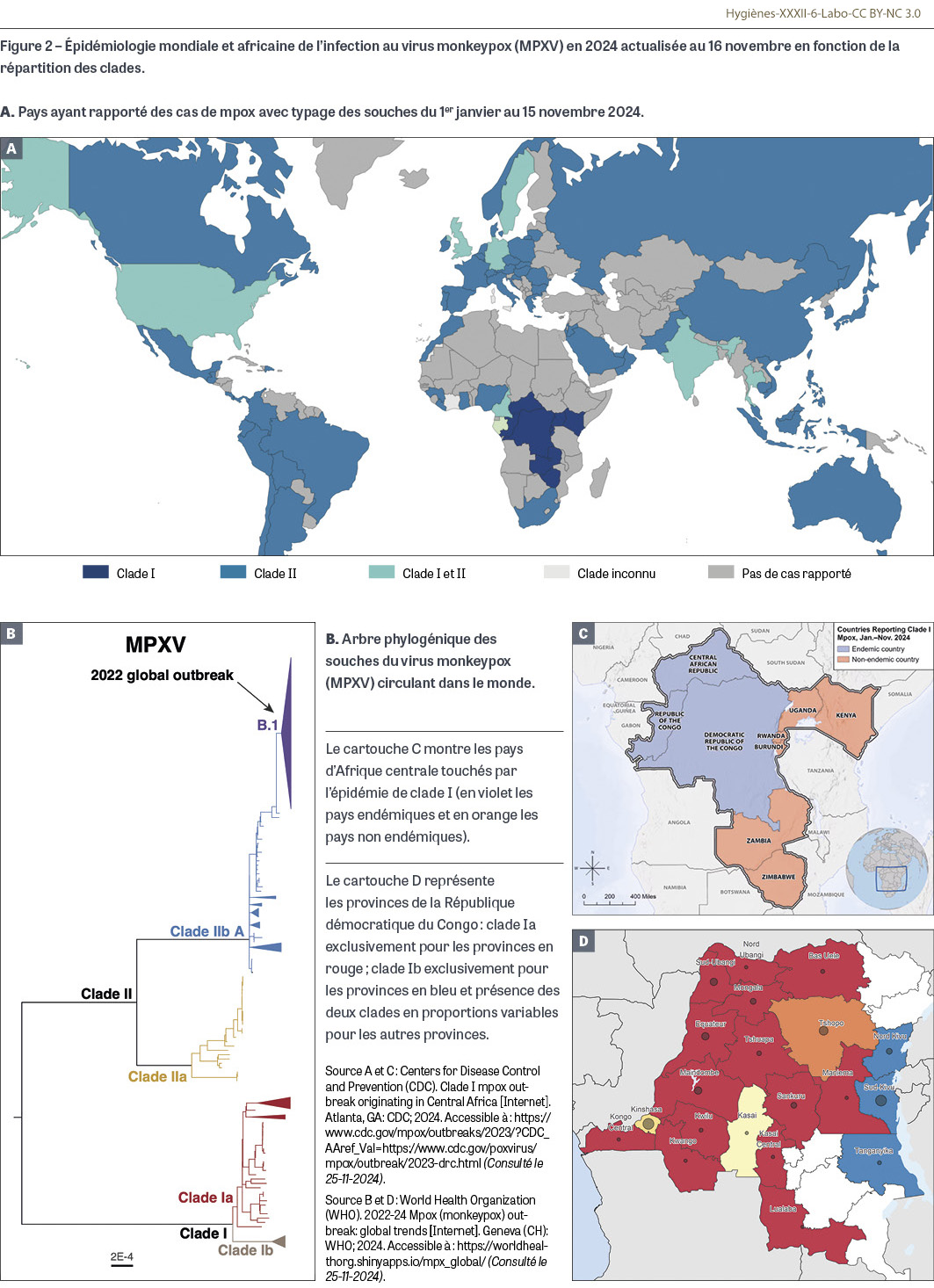
- En mai 2022, l’OMS a signalé l’apparition d’une épidémie touchant de nombreux pays non endémiques (donc essentiellement non africains) pour l’infection à MPXV [9] qui a été consécutive à la circulation mondiale d’une souche de clade IIb, largement prédominante au sein de la communauté des hommes ayant des relations sexuelles avec des hommes (HSH) et transmise à l’occasion de contacts intimes entre individus. C’est à l’occasion de cette épidémie que l’OMS a proposé de dénommer l’ex-variole du singe du terme plus neutre de mpox [10]. Après un pic au cours de l’été 2022 et la campagne de vaccination des HSH qui a suivi, l’épidémie de mpox a décliné avec encore quelque 9 000 cas au cours de 2024. Au total, entre le 1er janvier 2022 et le 8 novembre 2024, plus de 115 000 cas confirmés de mpox ont été rapportés à partir de 122 pays (dont seulement sept avaient déjà rapporté des cas avant 2022). Le nombre de décès a été de 176 (environ 1,7/1 000) dont 60 cas aux États-Unis, 34 cas au Mexique, 20 cas au Pérou et 16 cas au Brésil (Figure 2A) [11,12]. Avec près de 4 300 cas, la France se situe au 4e rang mondial du nombre de personnes infectées après les États-Unis, le Brésil et l’Espagne.
Le 14 août 2024, l’OMS a estimé que la recrudescence d’infections à MPXV en RDC et dans un nombre croissant de pays d’Afrique subsaharienne constituait une urgence de santé publique de portée internationale (USPPI) au titre du Règlement sanitaire international 2005 [13]. Le virus impliqué appartenait au clade I qui comporte des souches de sous-clade Ia plutôt d’origine zoonotique, avec une majorité de cas pédiatriques mais possiblement quelques transmissions à la suite de relations hétérosexuelles dans la ville de Kinshasa [14], et des souches de sous-clade Ib de transmission interhumaine, principalement dans le cadre de relations hétérosexuelles impliquant notamment des travailleurs du sexe mais aussi des enfants au sein de clusters intrafamiliaux [15]. Entre le 1er janvier et le 14 novembre 2024, plus de 10 000 cas de mpox et quelque 1 000 décès ont été signalés dans dix pays africains (par ordre décroissant RDC, Burundi, Ouganda, République centrafricaine, Rwanda, Congo, Kenya, Cameroun, Zimbabwe et Zambie) (Figure 2A). Le nombre de cas est certainement très sous-estimé. La zone où circule majoritairement le clade IIb par transmission hétérosexuelle concerne la partie est de la RDC (provinces du Nord-Kivu et surtout du Sud-Kivu, et plus accessoirement le Tanganyika) avec une extension à l’est vers le Burundi et l’Ouganda qui sont frontaliers avec le Sud-Kivu (Figure 2A). En novembre 2024, quelques cas importés d’infection à MPXV Ib hors d’Afrique ont été rapportés (cas isolés en Suède, Thaïlande, Inde, Allemagne, et un foyer familial de quatre cas à Londres) (Figure 2A). Le 16 novembre 2024, le premier cas importé d’infection à MPXV clade Ib aux États-Unis a été confirmé [16].
En situation interhumaine, le virus se transmet essentiellement par contacts rapprochés, qu’il s’agisse de contacts intrafamiliaux ou à l’occasion de relations sexuelles pour les épidémies de 2022 et 2024. Les particules respiratoires de grande taille, les fluides corporels et les vésicules cutanées constituent les sources les plus riches en particules virales infectieuses. Les contacts interhumains indirects par le biais de matériel contaminé par des sécrétions respiratoires ou des croûtes (literie, linge de toilette, vêtements, vaisselle, surfaces, matériel utilisé dans le cadre de soins, jouets sexuels…) sont une source accessoire de contaminations (voir plus loin).
La Figure 2B illustre la phylogénie des quatre principaux sous-clades Ia, Ib, IIa et IIb de MPXV [12].
Données cliniques et populations cible
Manifestations cliniques communes à toutes les formes
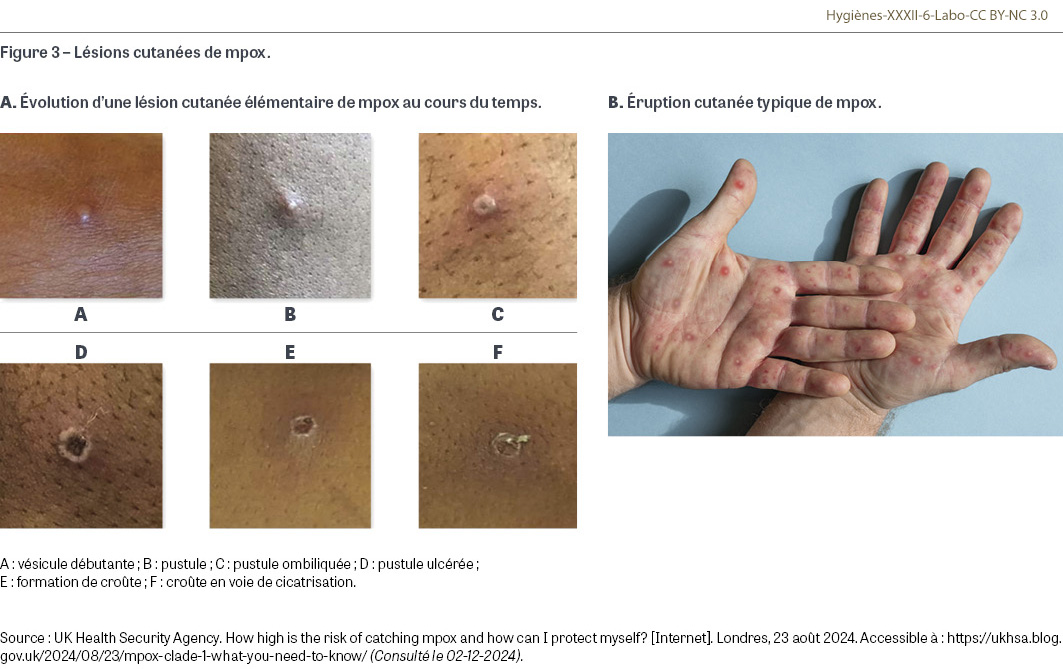
Après une incubation silencieuse de trois à vingt et un jours (moyenne de sept à dix jours), le patient présente une phase d’invasion d’un à deux jours pouvant associer une fièvre, des frissons, des courbatures, des céphalées, des lombalgies, de la fatigue et une ou plusieurs adénopathies. Puis survient la phase éruptive vésiculeuse de progression centripète avec une évolution typique des lésions (Figure 3). Contrairement à la varicelle ou au zona, les vésicules apparaissent en une seule floraison. La contagion s’étend sur toute la durée de l’éruption, soit environ trois semaines, jusqu’à la chute des croûtes, qui constituent aussi une source de contamination.
Formes cliniques
Les formes compliquées (surinfection bactérienne, forme cutanée généralisée, encéphalite, sepsis grave, infection pulmonaire…) se voient principalement chez les enfants, surtout avec le clade I, dont la mortalité peut atteindre 10% sur terrain fragilisé ou dénutri. Dans les formes africaines traditionnelles, l’éruption débute en général par la face, avec des lésions vésiculeuses pouvant intéresser toutes les parties du corps ; les adénopathies cervicales sont fréquentes. Au cours de l’épidémie de 2022 en relation avec le clade IIb (toujours en cours), la cible très prédominante a été la population HSH [17]. Des cas ont également été rapportés chez des animaux de compagnie [18,19]. Les prodromes sont parfois absents. Les lésions cutanées prédominent dans les régions génitales ou anales, avec parfois des formes ulcéreuses très algiques responsables des rares hospitalisations, mais peuvent aussi concerner la région oropharyngée. Les adénopathies inguinales sont fréquentes. L’évolution est en général favorable en trois semaines. L’association à des infections sexuellement transmissibles, dont le VIH, est fréquente. La mortalité est très réduite [17]. Au cours de cette épidémie, on peut signaler à titre anecdotique une épidémie de mpox survenue dans un salon de tatouage et de piercing à Cadix, Espagne [20,21] : vingt et un clients ont été contaminés au cours d’une période de quinze jours (vingt piercings en majorité au niveau des oreilles et un tatouage à l’avant-bras) [20] ; 67% des patients étaient des femmes (âge moyen : 26 ans) sans facteur de risque personnel. Le cas index a probablement été un client porteur d’une éruption vésiculeuse non étiquetée. La plupart des instruments testés rétrospectivement (15/16) ont été trouvés positifs par test PCR2. L’évolution a été favorable dans tous les cas [20,21]. Au cours de l’épidémie de 2024 dans le bassin du Congo en relation avec le clade II, la population cible est représentée par des adultes jeunes et des enfants, avec près d’un tiers de travailleuses du sexe pour les cas associés au clade IIb [15]. Chez les adultes, les lésions cliniques sont très similaires à celles décrites ci-dessus pour l’épidémie de 2022 avec prédominance des lésions dans la sphère génitale cutanée. L’évolution est favorable en trois ou quatre semaines dans la majorité des cas.
Diagnostic virologique au laboratoire
Tests PCR
Les tests PCR qui détectent la présence de l’ADN viral constituent la méthode diagnostique de choix. Il existe plusieurs tests commerciaux disponibles à cet effet. Les prélèvements à privilégier sont les prélèvements cutanés très riches en virus, prélèvement de la croûte d’une vésicule ou écouvillonnage de la lésion, qui sont ensuite conservés dans un milieu de transport viral. La biopsie cutanée est possible dans des cas particuliers pour les lésions sèches de type macule ou papule. Les prélèvements oropharyngés sont intéressants dans la phase prodromique ou au début de l’éruption. La recherche de l’ADN du virus dans le sang est moins performante compte tenu de la brièveté de la virémie (un à deux jours) avant les lésions muqueuses et cutanées. Les prélèvements doivent être réalisés par du personnel protégé et transportés en triple emballage selon la norme UN 3373 pour les cas suspects et la norme UN 2814 pour les cas probables ou confirmés. Les tests PCR sont également utilisables à partir de prélèvements environnementaux par écouvillonnage des surfaces suspectes d’être contaminées. Le dépistage moléculaire se fait si possible en laboratoire de sécurité de niveau 3 selon différentes modalités : PCR spécifique de l’espèce MPXV qui permet de confirmer ou non la présence du génome viral et d’affirmer le diagnostic ; PCR de genre orthopoxvirus nécessitant un test PCR réflexe d’espèce MPXV pour confirmation ; ou PCR spécifique de clade d’emblée dans les zones où ne circule qu’un seul clade. Les prélèvements testés positifs ne peuvent pas être conservés en dehors de laboratoires autorisés à les détenir (réglementation relative aux micro-organismes et toxines [MOT]). Le typage des souches au centre de référence français des orthopoxvirus, situé à Brétigny-sur-Orge, est important à titre épidémiologique, surtout pour les cas dont le mode de contamination n’est pas clairement avéré (cas importés notamment).
Autres méthodes virologiques
Les autres méthodes virologiques sont réservées aux laboratoires de référence dans le cadre d’investigations épidémiologiques : culture cellulaire sur cellules Vero pour tester la viabilité du virus, microscopie électronique, ou encore sérologie, notamment dans le cadre de l’évaluation des réponses vaccinales (avec l’écueil des réactions croisées communes au genre Orthopoxvirus chez les sujets déjà infectés par un autre orthopoxvirus ou vaccinés contre la variole).
Aspects thérapeutiques
Nous aborderons brièvement les antiviraux utilisables à titre curatif, rarement utilisés du fait du caractère bénin de la plupart des infections à mpox ou de leur faible disponibilité dans les pays africains, pour insister sur les approches vaccinales qui constituent la clé du contrôle de ces émergences.
Antiviraux disponibles à titre curatif
Très peu d’études de validation des antiviraux disponibles à titre curatif ont été conduites chez l’humain. Leur efficacité est essentiellement dérivée de travaux réalisés sur des modèles animaux (macaques infectés par MPXV, lapins blancs infectés par une souche de virus rabbitpox) [22].
- Le tecovirimat est un antiviral du laboratoire SIGA (New York, NY, États-Unis) inhibant l’activité de la protéine d’enveloppe VP37, codée par le gène F13L, très conservé chez les orthopoxvirus et indispensable à la dissémination du virus mature de cellule à cellule. Il est actif in vitro sur tous les orthopoxvirus testés dont le MPXV. Il est disponible en Europe et aux États-Unis par voie orale sous forme de gélules à 200 mg à prendre pendant 14 jours le plus tôt possible après le début de l’infection. Une forme intraveineuse est également autorisée aux États-Unis. Le produit est plutôt bien toléré malgré de possibles nausées ou céphalées. Il est contre-indiqué pour les femmes enceintes et les jeunes enfants (<13 kg).
- Le brincidofovir (Tembexa® du laboratoire Chimerix, Durham, NC, États-Unis), prodrogue du cidofovir, est autorisé aux États-Unis par voie orale (gélules et suspension buvable), y compris pour le nouveau-né. Il n’est pas disponible en Europe pour l’indication mpox.
- Le cidofovir, analogue nucléotidique de la cytidine pour de nombreuses polymérases virales, est utilisable à titre compassionnel par voie intraveineuse dans les formes graves d’infection à orthopoxvirus mais il est doté d’une forte toxicité rénale (risque de tubulopathie avec syndrome de Fanconi) et hématologique (neutropénie) ainsi que d’un potentiel effet carcinogène, tératogène et reprotoxique.
Prévention
En dehors des immunoglobulines humaines anti-vaccine récoltées chez des sujets fortement répondeurs après vaccination antivariolique (VAV) qui possèdent une autorisation de mise sur le marché aux États-Unis pour les femmes enceintes et les jeunes enfants, la prévention contre le MPXV repose sur la VAV du fait des réactivités croisées qui existent entre toutes les orthopoxviroses. Les vaccins de première et deuxième générations à base de virus vivant de la vaccine (VACV) ne sont plus recommandés du fait de leurs effets indésirables importants. La prophylaxie repose principalement sur les vaccins dits de troisième génération basés sur des souches vivantes de virus de la vaccine qui peuvent se multiplier en culture cellulaire mais qui ont perdu leur pouvoir de multiplication sur les cellules humaines, ce qui explique leur remarquable tolérance par rapport aux vaccins plus anciens. Deux vaccins de troisième génération [23] sont actuellement recommandés par l’OMS :
- MVA-BN (vaccins Imvanex® et Jynneos® de la firme germano-danoise Bavarian Nordic, Hellerup, Danemark) a été développé à partir d’une souche atténuée réplicative intitulée MVA pour modified vaccinia virus Ankara ; ce sont les vaccins recommandés par la Haute Autorité de santé contre la mpox dans les populations cibles (HSH en France), pour les contacts exposés à des cas de mpox et pour les soignants en contact avec ces patients [24]. Chez les sujets contacts, la vaccination doit être pratiquée dans les 4 à 14 jours suivant le contage ; le schéma recommandé comporte 2 doses de 0,5 ml espacées d’au moins 28 jours, injectées par voie sous-cutanée. Ce vaccin a été très largement utilisé au cours de l’épidémie de mpox de 2022, avec une remarquable efficacité et une très bonne tolérance. Cependant, il n’est pas autorisé chez les enfants de moins de 12 ans.
- LC16m8 a été développé par KM Biologics au Japon (Kumamoto) à partir de passages successifs de la souche Lister-Elstree du VACV [23]. Ce vaccin présente le même profil de sécurité et d’efficacité que le précédent. Il n’est pas disponible en Europe mais est utilisé pour le contrôle de l’épidémie de clade I en Afrique car il est autorisé pour les enfants à partir d’un an.
Le principal inconvénient de ces vaccins est leur prix de revient élevé qui limite leur capacité à être utilisés à grande échelle dans les pays à faibles revenus économiques. Des vaccins de quatrième génération créés à partir de souches de VACV modifiées génétiquement sont en cours de développement. C’est le cas du New York Vaccinia virus (NYVAC), qui dérive de la souche Copenhagen de VACV après la délétion de dix-huit cadres de lecture ouverts, résultant en un virus non réplicatif dans la plupart des lignées cellulaires de mammifères y compris celles d’origine humaine [25]. La taille importante de l’ADN des poxvirus en fait des vecteurs très intéressants pour l’insertion de séquences virales exogènes. On peut imaginer dans le futur des vaccins antivarioliques efficaces non seulement sur le MPXV et les autres orthopoxvirus mais aussi pour la prévention d’autres viroses d’importance [25]. Des vaccins spécifiques du MPXV sont aussi en cours d’élaboration.
Mpox du point de vue de l’hygiéniste
Sensibilité du monkeypox aux désinfectants
Le MPVX étant un virus enveloppé, il ne pose pas de problème particulier quant à sa sensibilité aux biocides. La plupart des études de sensibilité des orthopoxvirus aux désinfectants portent sur des souches de VACV [26]. Les résultats montrent une activité des produits hydro-alcooliques en moins d’une minute, des aldéhydes entre 0,05% et 0,5% en cinq minutes, du peroxyde d’hydrogène et de l’acide peracétique en moins d’une minute, et du chlore à 0,64% de chlore actif en une minute. En revanche, l’ozone, les ammoniums quaternaires et la chlorhexidine se sont montrés beaucoup moins actifs [26]. Une étude plus récente portant sur le MPXV a confirmé l’efficacité de l’hypochlorite de sodium à 0,05% et de l’éthanol à 70% pendant une minute pour la désinfection des surfaces poreuses et non poreuses [27].
Contamination environnementale par monkeypox
Si la transmission du MPXV est principalement médiée par les contacts rapprochés entre individus, différentes études mettent en évidence la présence de génome viral dans une proportion importante de prélèvements environnementaux [28,29,30,31]. Dans trois de ces quatre études, certaines cultures virales ont été positives, confirmant la viabilité du virus, même si les titres infectieux étaient faibles ; une des études montre que le virus est encore détectable dans le lieu de résidence des malades quinze jours après leur départ [29], et deux de ces études indiquent que le virus infectieux est trouvé plus volontiers sur les linges que sur les surfaces rigides [29,31]. Les cas de contamination à partir de matériel de tatouage ou de piercing rapportés plus haut confirment le rôle du matériel contaminé dans la transmission du MPXV [20,21]. Ce risque infectieux environnemental est également corroboré par quelques contaminations anecdotiques chez des soignants, le plus souvent lors d’une effraction cutanée, notamment lors de la réalisation des prélèvements diagnostiques. Dans un hôpital en Grande-Bretagne, avant 2022, un infirmier a été suspecté de s’être contaminé en changeant la literie d’un patient porteur d’une infection à MPXV documentée à retardement [32]. Par ailleurs, une publication datant de l’épidémie de mpox au Brésil en 2022 a rapporté une transmission croisée chez deux infirmières s’étant déplacées en voiture pour faire des prélèvements au domicile d’un sujet infecté : les deux soignantes avaient passé environ une heure auprès du patient, elles étaient masquées et avaient revêtu des gants lors des prélèvements, et aucun contact direct avec le patient n’avait été noté ; cinq jours plus tard, elles avaient développé une lésion vésiculeuse au niveau d’un doigt pour l’une et d’un avant-bras pour l’autre, associée à un tableau fébrile avec altération de l’état général. Les virus isolés chez les trois cas ont montré 100% d’homologie entre les trois souches. Le mode précis de contamination des deux infirmières reste indéterminé : exposition aux fomites présents dans le domicile du cas index, contact avec la boîte ayant servi à transporter les échantillons (qui n’a pas été désinfectée), manipulation impropre des masques [33] ? Il est à noter que la charge virale présente dans l’environnement privé immédiat d’un patient est probablement bien plus élevée qu’autour d’un patient hospitalisé dans un environnement bénéficiant au moins quotidiennement d’un bionettoyage avec des produits virucides. La contamination aérienne par le MPXV n’a jamais été démontrée : une étude récente s’est intéressée à la transmission du clade IIb lors de vols en avion et a montré qu’aucun des 1 046 passagers situés à proximité de 113 cas confirmés n’avait été contaminé durant ces vols [34].
Recommandations internationales et nationales
Dans la suite des émergences du MPXV en 2022 puis 2024, de multiples recommandations ont été émises tant au niveau international (OMS, Centers for Disease Control and Prevention américains, European Centre for disease Prevention and Control, African Centers for Disease Control and Prevention) que national (Haut conseil de la santé publique [HCSP], Société française de pathologie infectieuse, Société française d’hygiène hospitalière [SF2H]) à l’attention des patients, des cas contacts et des soignants. Le HCSP a émis des recommandations pour l’isolement des patients porteurs de formes bénignes de mpox et des mesures d’hygiène à respecter pour eux, les contacts proches et les soignants (Tableaux I et II) [35,36]. À ce propos, il est intéressant de noter que la SF2H s’est positionnée un peu différemment du HCSP par rapport à la protection respiratoire, estimant que la transmission par aérosol n’était pas avérée en milieu de soins et que l’utilisation de précautions complémentaires respiratoires simples (masque à usage médical) était suffisante et moins contraignante pour protéger les soignants, en association avec les précautions complémentaires de type contact qui reste le principal mode de transmission du mpox en milieu de soins [37,38]. D’autres recommandations françaises sont disponibles pour les durées d’éviction lors de dons de produits issus du corps humain [39] ainsi que pour les voyageurs se rendant dans les régions d’Afrique où circule activement le clade I du MPXV [40].
Conclusion
L’évolution récente de l’épidémiologie du MPXV avec l’apparition d’une transmission interhumaine d’au moins deux lignages zoonotiques successifs (clade IIb puis clade Ib et peut-être Ia) est la résultante de l’effondrement de la barrière immunitaire anti-orthopoxvirus qui avait été instaurée par la vaccination antivariolique, et de changements socio-économiques et comportementaux (déforestation, conflits armés, mobilité accrue des individus à titre individuel et collectif…) qui facilitent les émergences virales. Les éléments un peu rassurants sont le caractère relativement bénin de la très grande majorité des formes cliniques et la capacité des vaccins actuels à contrôler la progression des cas sous réserve de leur disponibilité en quantité suffisante. Dans ce contexte, l’hygiéniste doit veiller à recommander les meilleures dispositions pour accompagner les mesures vaccinales à la fois pour les patients, leur entourage et les soignants dans la mesure où la mise en place de précautions complémentaires adaptées pour les cas pendant la phase éruptive reste sans doute le meilleur moyen de limiter la dissémination virale.
Notes :
1- Acide désoxyribonucléique.
2- Polymerase chain reaction, amplification en chaîne par polymérase.