Après avoir décrit le rôle de Pseudomonas aeruginosa dans la survenue des infections associées aux soins, nous allons nous intéresser à la bactérie Stenotrophomonas maltophilia (Sm), « cousine » de P. aeruginosa avec qui elle partage son origine environnementale et sa capacité à coloniser puis infecter les patients hospitalisés ou présentant des pathologies respiratoires chroniques [1]. Comme P. aeruginosa, Sm fait partie de la famille des opportunistic premise plumbing pathogens (OPPP) en raison de sa capacité à persister dans les réseaux de plomberie et sur les surfaces humides, de sa versatilité métabolique et de sa résistance aux agents antimicrobiens [1]. Cette multirésistance naturelle aux antibiotiques, et notamment sa résistance aux carbapénèmes utilisés pour traiter les infections à entérobactéries productrices de bêtalactamases à spectre élargi (EBLSE), lui permet de profiter de la pression antibiotique pour émerger dans un service ou chez un patient. Cette bactérie pose des problèmes à la fois aux hygiénistes, aux infectiologues et aux bactériologistes.
Stenotrophomonas maltophilia, l’archétype de la bactérie environnementale opportuniste à l’origine d’infections associées aux soins
Autrefois considéré comme un micro-organisme peu virulent, Sm est devenu un pathogène opportuniste d’intérêt à l’origine d’infections associées aux soins (IAS) en milieu hospitalier, en particulier chez les patients immunodéprimés. À l’échelle mondiale, Sm occupe la troisième place parmi les quatre bacilles à coloration de Gram négative non fermentants pathogènes les plus fréquents, en compagnie de Pseudomonas aeruginosa, Acinetobacter baumannii et du complexe Burkholderia cepacia [2,3,4]. L’Organisation mondiale de la santé le classe actuellement comme l’un des plus importants agents pathogènes multirésistants aux antibiotiques au sein des bactéries à Gram négatif responsables d’infection dans les hôpitaux [2,3,4].
Historique et habitat naturel
Sm est un bacille à coloration de Gram négative, initialement appelé Bacterium bookeri lorsqu’il a été identifié par J. L. Edward pour la première fois en 1943 à partir d’un échantillon de liquide pleural humain. Il a ensuite été classé comme Pseudomonas maltophilia en 1961 à partir d’un patient atteint d’un carcinome buccal, puis réaffecté à la classe des gammaprotéobactéries sous le nom de Xanthomonas maltophilia en 1983, et enfin classé au sein du genre Stenotrophomonas en 1999. Le nom a des racines grecques qui signifient « mangeur étroit qui aime le malt », en référence à son métabolisme (cf. infra). Sm est omniprésent dans la nature : il existe dans différents types d’environnements et dans des régions géographiques extrêmes telles que l’Antarctique. Sm peut être trouvé dans le sol, les plantes et leur rhizosphère (partie du sol exposée aux racines des plantes) ainsi que chez les animaux ; Sm est également un contaminant courant de l’eau [2]. Il interagit en milieu aqueux avec d’autres micro-organismes en suspension et potentiellement avec l’homme. Certaines amibes libres comme Acanthamoebae hébergent Sm, et peuvent en constituer un réservoir et le protéger des agents désinfectants comme le chlore ajouté à l’eau [3]. Il existe d’autres espèces appartenant au genre Stenotrophomonas mais qui ne sont qu’exceptionnellement retrouvées en pathologie humaine : S. rhizophila, S. geniculata, S. pavanii, S. sepilia…
Pouvoir pathogène chez l’homme
Sm est quasi exclusivement associé à des IAS. Les infections communautaires ne sont retrouvées que chez des patients atteints de pathologie respiratoire chronique et surexposés aux antibiotiques. Sm est à l’origine de diverses infections, notamment des infections des voies respiratoires (pneumonies et exacerbations aiguës de la bronchopneumopathie chronique obstructive), des bactériémies, des infections des os et des articulations, des infections urinaires, ainsi que de rares cas d’endocardites et de méningites. Comme pour P. aeruginosa, le pouvoir pathogène de Sm peut s’exprimer sur un mode aigu ou chronique : infections aiguës chez des patients présentant une immunodépression générale ou locale et porteurs de dispositifs invasifs (cathéters veineux centraux, sondes d’intubation…), surinfections à l’origine d’exacerbations chez des patients colonisés de façon chronique au niveau respiratoire dans un contexte d’inflammation persistante (mucoviscidose, bronchopneumopathie chronique, dilatation des bronches…). Parmi les facteurs de risque d’infection à Sm, on retrouve une hospitalisation prolongée nécessitant des procédures invasives, l’admission dans une unité de soins intensifs, la présence d’un cathéter à demeure, la ventilation mécanique et l’exposition récente aux antibiotiques. L’incidence et le taux de mortalité des infections à Sm ont fait l’objet de nombreuses publications dans différents pays [2-6]. Une étude mondiale réalisée dans le cadre du programme de surveillance antimicrobienne Sentry a rapporté pour la période 1997-2008 un taux d’incidence de Sm de 3,1% parmi les patients hospitalisés souffrant de pneumonie [3] ; ce taux a atteint 4,4% aux États-Unis entre 2009 et 2012. Une augmentation du taux d’incidence de Sm de 6,7% à 12% a été observée chez les patients atteints de mucoviscidose. Sm a été l’un des six principaux agents pathogènes isolés chez des patients atteints de pneumonie dans des unités de soins intensifs aux États-Unis entre 2015 et 2017, et l’un des dix principaux agents pathogènes à l’origine d’une pneumonie chez des patients dans des centres médicaux d’Amérique latine entre 2008 et 2010 [4]. Chez les enfants, Sm se classe parmi les quinze premiers pathogènes en Europe, en Amérique latine et en Asie. Comme tout pathogène opportuniste, le taux de mortalité associée aux infections à Sm varie selon le type de patient concerné. Il est néanmoins élevé, allant de 23% à 77% et de 21% à 62% en cas de pneumonie ou de bactériémie [5]. La part de cette mortalité liée à l’infection et celle liée au terrain initial restent à préciser, d’autant que Sm est parfois associé à d’autres bactéries lorsqu’il est identifié chez l’homme à partir d’un prélèvement clinique d’un site non stérile.
Caractéristiques microbiologiques
Sm est un bacille à Gram négatif aérobie obligatoire qui a la forme d’un bâtonnet et qui est mobile avec quelques flagelles polaires. Il ne fait pas fermenter le glucose, contrairement aux entérobactéries comme Escherichia coli. Il est capable de persister dans des environnements aqueux pauvres en nutriments. C’est une bactérie dont les exigences nutritives sont limitées ; elle est dite « auxotrophe » car elle a un besoin indispensable de méthionine pour se multiplier. Sm se développe en 18-24 heures sur milieu ordinaire (gélose trypticase-soja), sur milieu enrichi (gélose au sang, gélose au sang cuit dit « chocolat ») et sur les principaux milieux sélectifs pour les bacilles à Gram négatif (gélose Drigalski ou MacConkey) (Figure 1). En raison de sa résistance naturelle aux carbapénèmes, Sm se développe sur les milieux sélectifs utilisés pour le dépistage des entérobactéries productrices de carbapénémase [6,7]. Concernant la température optimale de culture, certaines souches de Sm isolées de l’environnement se développent mieux à 30°C qu’à 37°C. C’est une particularité retrouvée chez de nombreuses bactéries environnementales. L’expression de la résistance naturelle peut également être favorisée par cette température (cf. infra).
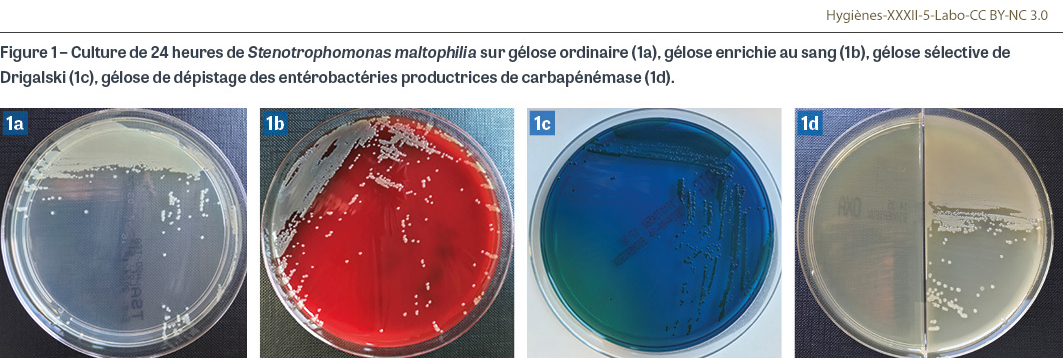
Identification au laboratoire
Les colonies obtenues en culture ne sont ni pigmentées ni muqueuses, ce qui permet de les différencier d’autres bactéries qui ne fermentent pas le glucose. Elles sont généralement de couleur jaune-vert sur la gélose nutritive ordinaire (certaines souches voient leurs colonies brunir), non hémolytiques avec une décoloration verdâtre (parfois couleur dite « lavande ») du milieu accompagnée d’une odeur d’ammoniac sur la gélose au sang, et vert foncé sur les géloses sélectives Drigalski car ne fermentant pas le lactose. Elles peuvent ressembler aux colonies de Pseudomonas sp. du fait de leur surface plate opaque aux bords irréguliers [7]. Au-delà des caractéristiques microbiologiques de base (aérobiose stricte, test de l’oxydase négatif dans 80% des cas), la confirmation de l’identification se faisait historiquement par des galeries de tests biochimiques adaptées aux bacilles non fermentants et qui mettaient en évidence notamment sa capacité à assimiler le maltose (Figure 2). L’identification par spectrométrie de masse MALDI-TOF (matrix assisted laser desorption ionization time-of-flight1) est aujourd’hui la technique d’identification de référence dans les laboratoires de microbiologie : cette technologie identifie Sm facilement, sans séparer les sous-populations s’éloignant génétiquement de l’espèce « type » (cf. infra).
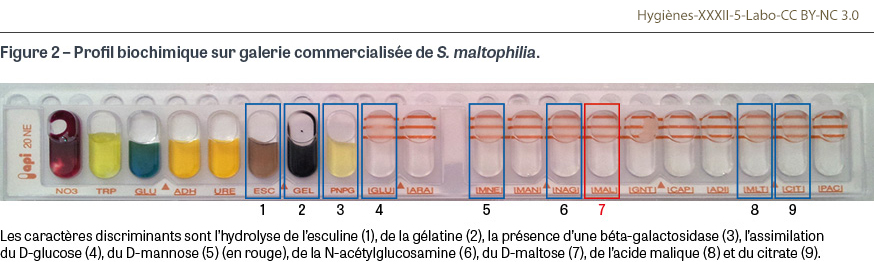
Multirésistance aux antibiotiques
Résistances naturelles
Une des principales caractéristiques de Sm est sa multirésistance naturelle à de nombreux antibiotiques, ce qui lui donne un avantage sélectif certain notamment lorsque des molécules à large spectre sont utilisées. La comparaison des profils de sensibilité aux antibiotiques de deux souches de phénotype sauvage (c’est-à-dire sans résistance acquise) de P. aeruginosa et de Sm montre que Sm est naturellement résistant à de nombreuses molécules pourtant efficaces chez P. aerurginosa (Figure 3). Seuls l’association sulfaméthoxazole-triméthoprime (appelée également cotrimoxazole) et les antibiotiques de la famille des fluoroquinolones restent efficaces. Les bêtalactamines (pénicillines et céphalosporines) et les aminosides, les deux principales classes de molécules utilisées en milieu hospitalier, sont inefficaces même si la résistance naturelle s’exprime mieux pour cette dernière famille d’antibiotiques à 30°C qu’à 37°C. Cela est dû à la présence d’enzymes inactivant les antibiotiques, et notamment deux bêtalactamases L1 et L2 à large spectre présentes sur le chromosome bactérien et dont l’expression phénotypique peut varier : L1 est une bêtalactamase de classe B de type carbapénémase et L2 une bêtalactamase de classe A de type BLSE [1]. Il est intéressant de souligner que l’on retrouve naturellement chez Sm les deux enzymes les plus importantes pour la résistance à large spectre aux bêtalactamines. Les inhibiteurs de bêtalactamase comme l’acide clavulanique ou l’avibactam sont efficaces contre l’enzyme L2 : des images de synergies en « bouchons de champagne » apparaissent sur certains antibiogrammes quand l’expression de L1 – qui, elle, est insensible à ces inhibiteurs – n’est pas trop importante (Figure 3). La présence également d’une acétyltransférase confère une résistance aux aminoglycosides. Plusieurs autres résistances antimicrobiennes sont dues à la présence de pompes d’efflux expulsant les molécules à l’extérieur de la bactérie comme SmeDEF et SmeABC qui agissent sur les quinolones, les aminoglycosides, les macrolides et les tétracyclines.

Résistances acquises
La figure 4 présente les antibiogrammes de deux souches de Sm ayant acquis une résistance aux fluoroquinolones et/ou au cotrimoxazole. Les résistances acquises sont dues à l’incorporation de nouveaux gènes (sul1, sul2 et dfrA2 entraînant la résistance de haut niveau au cotrimoxazole), à l’apparition de mutations sur des gènes cibles (gyrase et topo-isomérase pour la résistance aux quinolones), ou à la surexpression des pompes d’efflux présentes naturellement chez Sm [2]. Des phénomènes acquis d’imperméabilité peuvent aussi empêcher certains antibiotiques d’agir. Parmi les éléments génétiques mobiles responsables de l’acquisition de gènes de résistance additionnels, les intégrons jouent un rôle important contrairement aux plasmides ; cette situation diffère de celle rencontrée chez les entérobactéries.

Diversité génétique et organisation phylogénétique de Stenotrophomonas maltophilia
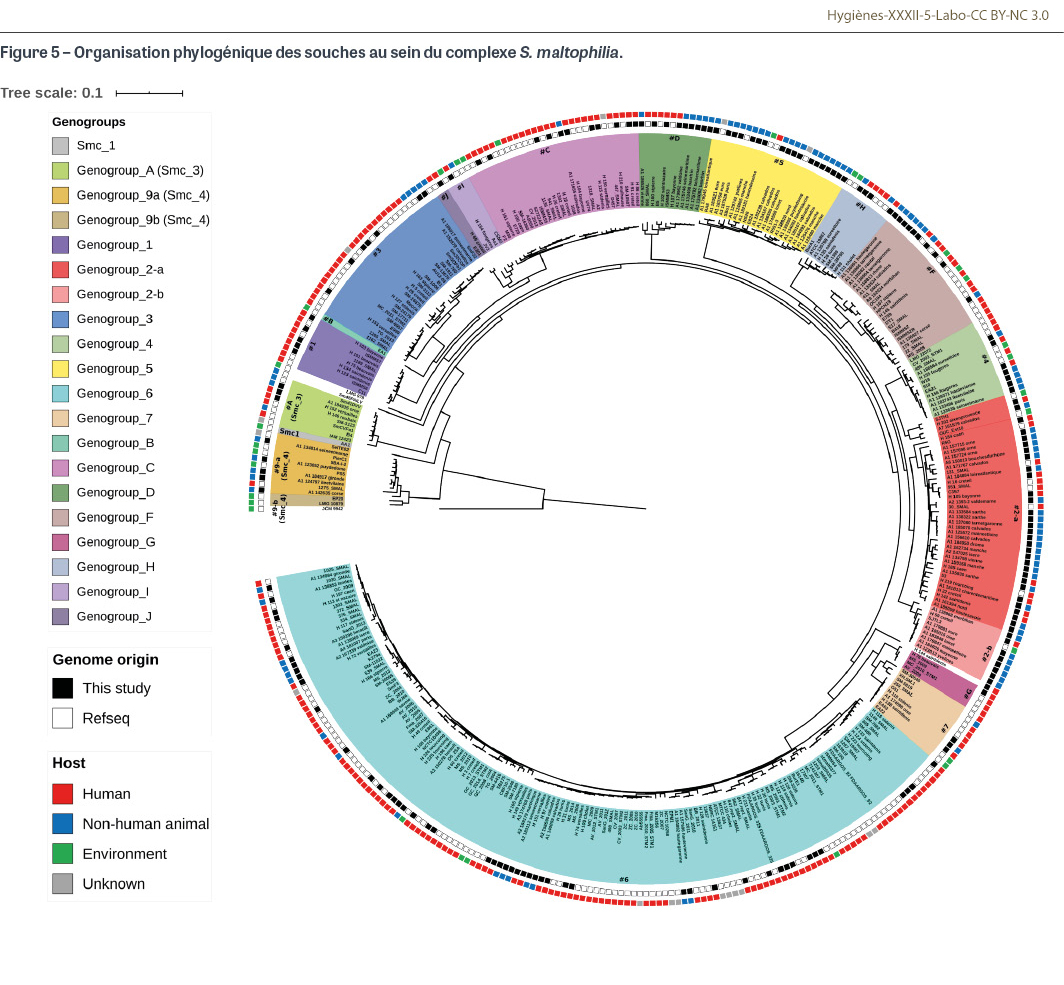
Le séquençage et la comparaison de certains gènes ont permis d’évaluer l’organisation génétique des différentes souches de Sm entre elles. La démocratisation du séquençage complet des génomes bactériens a permis de préciser cette organisation. Génétiquement, il existe une très grande diversité au sein des différentes souches de Sm, qui se rassemblent sous la forme de sous-populations individualisées appelées génogroupes. Cette catégorisation génétique se traduit également par des caractéristiques phénotypiques : certains de ces génogroupes sont ainsi préférentiellement retrouvés chez l’homme (génogroupes 2 et 6) ou chez l’animal (génogroupes 5 et 9) [8,9]. La majorité des souches humaines appartiennent au génogroupe 6. Le nombre de ces génogroupes évolue avec le temps : une vingtaine a été décrite à ce jour [10-12] (Figure 5). L’espèce telle que définie par les techniques phénotypiques comme la spectrométrie de masse MALDI-TOF est en fait un complexe d’espèces qui s’organise autour d’une espèce type (S. maltophilia sensu stricto) regroupant les souches de génogroupe 6 majoritairement retrouvées chez l’homme ; de nombreux autres génogroupes entourent cette espèce type en s’en éloignant génétiquement de plus en plus. Ils forment ainsi l’espèce S. maltophilia sensu lato qui les regroupe autour de l’espèce S. maltophilia sensu stricto. Génétiquement, certaines de ces sous-populations s’éloignent tellement de l’espèce type qu’elles constituent des « espèces génétiques » à part entière (« genospecies »). Cette grande diversité génétique qui n’est donc pas mise en évidence par les techniques d’identification phénotypique utilisées en routine explique des phénotypes de résistance aberrants retrouvés parfois pour certaines souches (profils hypersensibles aux antibiotiques avec perte de certaines résistances naturelles). Ces dernières souches sont probablement très éloignées génétiquement de l’espèce type et n’en partagent donc pas les caractéristiques phénotypiques intrinsèques.
Réservoir environnemental hospitalier
Dans les hôpitaux, l’eau du robinet est une ressource cruciale dont la qualité microbiologique est primordiale en raison de ses nombreux usages : hygiène des patients, lavage des mains du personnel soignant, administration de médicaments et consommation. Les réseaux d’eau hospitaliers sont généralement alimentés par de l’eau municipale répondant aux normes de qualité de l’eau potable, mais ils peuvent contenir des bactéries hydrophiles autochtones, considérées comme des pathogènes opportunistes. Ces bactéries peuvent se multiplier dans les réseaux d’eau et causer des IAS chez les personnes vulnérables. Parmi ces pathogènes opportunistes retrouvés dans l’eau, P. aeruginosa et Sm sont des agents multirésistants responsables d’IAS et d’épidémies nosocomiales. Contrairement à P. aeruginosa, Sm n’est pas recherché spécifiquement dans les eaux pour soins standards [12,13]. Il est néanmoins considéré comme un germe « indicateur » d’une contamination par des micro-organismes hospitaliers lors des prélèvements réalisés sur les endoscopes [14]. Importé par l’eau des réseaux d’alimentation, Sm peut ensuite coloniser les circuits d’évacuation des eaux usées, à commencer par les siphons. Sm a également la capacité de former un biofilm sur tout type de surface humide : il peut ainsi coloniser les circuits d’inspiration et d’expiration des ventilateurs, les endoscopes, les robinets, les pommeaux de douche, les savons pour le lavage des mains, l’eau d’hémodialyse et le dialysat des unités rénales, les nébuliseurs, les canalisations des fontaines…
Modes de transmission
La place respective des différents modes de contamination des patients par Sm à l’hôpital est discutée. La première hypothèse est la sélection endogène : le patient arrive déjà colonisé par Sm, probablement à partir de son environnement personnel (exposition à de l’eau contaminée ou à des aliments à son domicile). La pression de sélection liée à la prescription d’antibiotiques à l’hôpital fait émerger cette bactérie déjà présente au sein de ses microbiotes respiratoires, digestifs ou cutanés initialement en quantité non détectable par les méthodes bactériologiques classiques. Une autre possibilité est la contamination du patient à partir des réservoirs environnementaux présents à l’hôpital, soit directement (exposition), soit indirectement par l’intermédiaire de matériels contaminés ou par les mains des soignants elles-mêmes contaminées. Enfin, la transmission croisée de patient à patient manuportée ou via du matériel contaminé est également possible. L’approche de séquençage systématique des souches de Sm provenant de patients hospitalisés ainsi que de leur environnement (siphons, endoscopes…) permet d’étudier l’épidémiologie des infections et des colonisations à Sm en établissement hospitalier, et de mieux en comprendre et quantifier les différents mécanismes.
Point de vue des infectiologues
Pour les cliniciens, la principale question concernant l’identification d’une souche de Sm d’un prélèvement non stérile (prélèvement respiratoire par exemple) est son éventuel caractère pathogène : le patient est-il seulement colonisé ou bien infecté ? Dans cette dernière situation ou lorsque la souche est isolée d’un site stérile (hémoculture), les options thérapeutiques ne sont pas nombreuses au regard de la multirésistance naturelle évoquée précédemment : l’association sulfaméthoxazole-triméthoprime et la lévofloxacine sont les deux molécules de première intention. En cas de résistance acquise ou d’intolérance à l’une des molécules ou aux deux, les alternatives sont la minocycline, un ancien antibiotique de la famille des tétracyclines, ou le céfidérocol, une nouvelle bêtalactamine classée comme céphalosporine sidérophore.
Point de vue des hygiénistes
Sm est à l’origine de nombreuses questions pour l’hygiéniste. Le caractère multi voire toto-résistant (résistance à tous les antibiotiques) contraste avec l’absence de recommandations concernant la mise en place de précautions complémentaires de type contact chez les patients colonisés. Cette discordance est encore moins explicable lorsque plusieurs patients sont colonisés dans un même service. Dans ce cas, la question du mode d’acquisition fait, elle aussi, l’objet d’hypothèses différentes : transmission croisée, contamination à partir de l’environnement, infection endogène chez des patients préalablement colonisés à des seuils infracliniques ? Les conséquences en termes de mesures de prévention ne sont pas les mêmes :
- mise en place des précautions complémentaires contact, renforcement de l’hygiène des mains, de la désinfection du matériel et du bionettoyage des surfaces en cas de suspicion de transmission croisée ;
- prélèvements d’environnement, désinfection des siphons et filtration des points d’eau en cas de suspicion de source environnementale ;
- renforcement de la juste prescription des antibiotiques avec limitation des molécules à large spectre comme les carbapénèmes en cas de suspicion d’infection endogène.
L’hygiéniste doit s’appuyer sur des prélèvements d’environnement et sur le typage des souches pour choisir la meilleure option.
Point de vue du microbiologiste
Sm est un modèle très intéressant d’opportunisme et d’adaptation à l’homme d’une sous-population particulière à partir d’une espèce bactérienne présentant une très forte diversité génétique initiale. L’environnement est reconnu comme un énorme réservoir d’espèces bactériennes et une source d’agents pathogènes pour l’homme. Certaines bactéries environnementales ont une gamme très étendue d’activités qui comprennent la promotion de la croissance des plantes, la décomposition des polluants, la production de biomolécules originales, mais aussi la résistance à plusieurs antibiotiques et l’acquisition d’un pouvoir pathogène chez l’humain fragilisé ou immunodéficient. La polyvalence du mode de vie bactérien dans l’environnement implique une adaptation à diverses niches. Il est ainsi possible de s’interroger sur le support génétique ou les caractéristiques phénotypiques qui font que les souches de génogroupe 6 sont principalement responsables des infections par Sm chez l’homme. Les hypothèses sont multiples : présence de gènes de virulence particuliers, voies métaboliques adaptées au microbiome humain, avantages sélectifs via des bactériocines par rapports aux autres sous-populations de Sm. L’étude plus approfondie de ces différentes options permettra de mieux comprendre l’évolution et, le cas échéant, l’émergence de nouveaux pathogènes opportunistes.
Conclusion
L’émergence et le rôle croissant de Stenotrophomonas maltophilia en tant que bactérie responsable d’infections associées aux soins sont étroitement liés à la formidable diversité et capacité d’adaptation des micro-organismes de l’environnement, ainsi qu’à la pression antibiotique toujours croissante au sein des hôpitaux. Les stratégies efficaces contre la diffusion de Sm combinent donc la gestion du risque infectieux lié à l’environnement, la lutte contre la transmission croisée et la juste utilisation des antibiotiques, ce qui constitue un parfait résumé des missions des équipes opérationnelles d’hygiène (EOH) ou de prévention du risque infectieux (Epri) et des équipes mobiles d’infectiologie.
Notes :
1- [Spectrométrie de masse] à temps de vol pour la désorption-ionisation laser assistée par matrice.
2- Sul : [résistance aux] sulfamides ; dfrA : dihydrofolate réductase de type A.